STUDIU. Noi date confirmă siguranța terapiilor celulare CAR-T: riscul de cancere hematologice secundare este scăzut
Un nou studiu realizat Universitatea de Medicină Stanford arată că riscul cancerelor secundare de sânge după terapia cu celule CAR-T este redus, confirmând profilul de siguranță al acestui tip de tratament oncologic inovator, autorizat pentru prima dată în 2017. Rezultatele sunt publicate în New England Journal of Medicine.
În noiembrie 2023, Administrația pentru Alimente și Medicamente (FDA) a emis un avertisment pentru includerea, în rezumatul caracteristicilor produselor CAR-T, date despre riscurile potențiale ale cancerelor secundare, în special ale celor de sânge.
Cu toate acestea, cercetarea, care a cuprins peste 700 de pacienți tratați la Stanford Health Care, arată că probabilitatea de a dezvolta cancere secundare de sânge după terapie este relativ scăzută, aproximativ 6,5% în trei ani după tratament. Această descoperire este esențială, mai ales în lumina unui incident fatal în care un pacient a dezvoltat un cancer secundar cu celule T. Studiul a clarificat că acest caz a fost determinat de starea de imunosupresie a pacientului, care a permis proliferarea celulelor canceroase anterior nedetectate, și nu a fost cauzat direct de terapia CAR-T în sine.
Prof. Ash Alizadeh și echipa sa au efectuat analize extinse, examinând nivelurile de proteine, secvențele de ARN și ADN-ul din celule unice din diferite țesuturi și în diferite momente în timp. Rezultatele au arătat că limfomul găsit la pacientul menționat anterior era deja prezent la niveluri scăzute înainte de tratament, respingând ideea că terapia CAR-T poate induce noi cancere.
Problema cancerelor secundare induse de tratamentele oncologice este un subiecte de cercetare, în special pentru cele care implică modificări genetice semnificative. Chimioterapia și radioterapia sunt cunoscute de mult timp pentru că pot cauza mutații genetice în celulele sănătoase, ceea ce poate duce la noi cancere. Acest studiu, totuși, asigură că terapia CAR-T minimizează probabilitatea unor astfel de consecințe nedorite, asigurându-se că genele terapeutice introduse în celulele T nu perturbă funcțiile celulare normale.
Cercetarea a comparat de asemenea ratele cancerelor secundare între beneficiarii terapiei CAR-T și cei care au suferit transplanturi de celule stem, găsind rate similare de dezvoltare a cancerului. Această comparație este importantă deoarece pune riscurile asociate cu terapia CAR-T în perspectivă, subliniind că profilul său de siguranță este comparabil cu alte tratamente pentru care există mai multe date de urmărire pe termen lung.
În plus, studiul oferă un model pentru monitorizarea pacienților care primesc terapia CAR-T. Identificând factorii care pot crește riscul de cancere secundare, cum ar fi imunosupresia preexistentă sau profilurile genetice specifice, medicii pot gestiona și monitoriza mai bine pacienții la risc.
Descoperirile acestui studiu sunt așteptate să aibă un impact semnificativ, modificând posibil modul în care comunitatea medicală percepe riscurile asociate cu terapia celulelor CAR-T. De asemenea, are implicații pentru autoritățile de reglementare, influențând posibil viitoarele avertizări și ghiduri ale FDA în legătură cu acest tratament.
Echipa de cercetare a evidențiat abordarea investigativă riguroasă întreprinsă, utilizând biobanca de țesuturi și probe de sânge de la Stanford Medicine. Această resursă a permis o examinare detaliată a caracteristicilor genetice și moleculare ale cancerelor care s-au dezvoltat post-terapie, confirmând că aceste cancere nu au fost cauzate de celulele T modificate genetic utilizate în tratamentele CAR-T.
Terapia celulară presupune transferul de celule pentru a înlocui sau a repara țesuturi afectate. CAR-T reprezintă o schimbare radicală față de toate formele de tratament existente până în prezent. Aceasta presupune reprogramarea celulelor imune ale pacientului să lupte împotriva cancerului și este considerat un tratament cu potențial curativ. CAR-T reprezintă o nouă dimensiune a personalizării tratamentului în oncologie, reprezentând în același timp o terapie genică, terapie celulară și o imunoterapie.
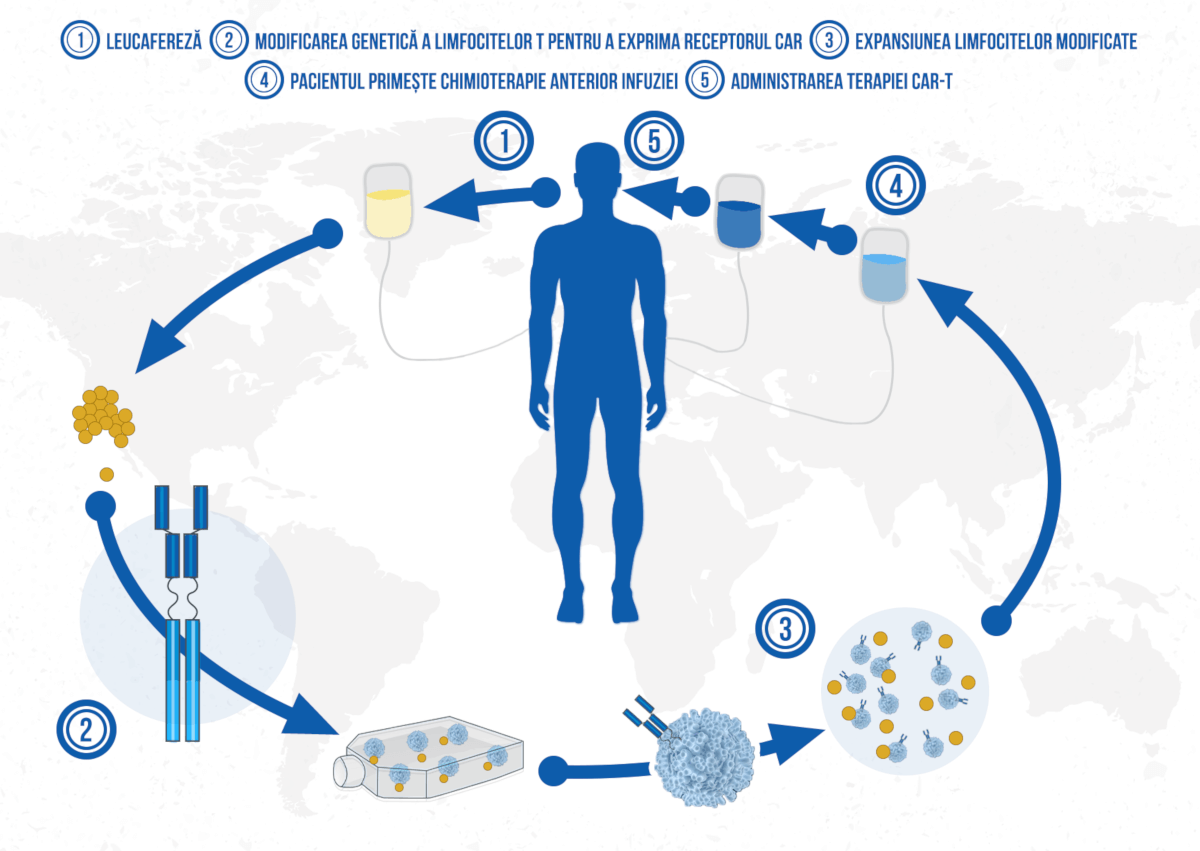
Aprobarea primelor terapii CAR-T a marcat un pas major în tratamentul cancerului. În august 2017, FDA a aprobat prima terapie cu celule CAR-T, tisagenlecleucel, pentru pacienții cu vârsta de până la 25 de ani care suferă de leucemie limfoblastică acută precursor B-celulară (ALL) refractară sau în a doua sau ulterioară recidivă. Acesta a fost un pas semnificativ, deoarece ALL este cel mai comun cancer la copii, iar până atunci, cei cu ALL recidivată sau refractară aveau opțiuni de tratament foarte limitate. Aprobarea a fost bazată pe studii clinice care au arătat rate remarcabil de înalte de remisie într-o populație de pacienți care epuizase alte opțiuni de tratament, oferind nu doar speranță, ci o promisiune reală de supraviețuire prelungită.
Urmând îndeaproape, în octombrie 2017, o altă terapie CAR-T, axicabtagene ciloleucel, a fost aprobată pentru pacienții adulți cu anumite tipuri de limfom non-Hodgkin (NHL), inclusiv pentru cei care au recidivat după două sau mai multe tipuri de tratament. Aceleași terapii au fost aprobate și în Uniunea Europeană. Extinderea indicațiilor a continuat cu terapii noi care vizează alte forme de cancere de sânge și chiar tumori solide, demonstrând versatilitatea și rolul terapiilor CAR-T în personalizarea tratamentului.
Aceste terapii au deschis calea către o nouă eră în tratamentul oncologic, schimbând abordarea de la chimioterapia tradițională la modificări genetice țintite ale celulelor imune ale pacientului pentru a lupta împotriva cancerului.
Citește și
- Terapiile celulare CAR-T în sistemul de sănătate din România: lansarea Cartei Albe a terapiilor celulare 2020
- #BiotechWeek2020. Ce sunt și cum funcționează terapiile celulare CAR-T?
- Terapiile CAR-T, o nouă dimensiune a personalizării tratamentului oncologic: cum diferă față de terapiile clasice și care sunt progresele în managementul cancerelor hematologice

