STUDIU. Un nou mecanism de reparare a ADN-ului ar putea explica legătura dintre consumul de alcool și riscul de cancer
ADN-ul din celulele noastre este susceptibil la deteriorare, iar cauzele sunt multiple – de la radiaţii, la substanţe toxice. Una dintre aceste substanțe toxice este alcoolul. Specialiștii din cadrul Institutului Hubrecht (KNAW) din Olanda şi din cadrul Laboratorului de Biologie Moleculara din Cambridge, Marea Britanie au descoperit un mod prin care organismul uman repară alterările ADN-ului cauzate de un compus rezultat în urma metabolizării alcoolului.
Astfel, este evidențiată legătura între consumul de alcool şi cancer. Lucrarea a fost publicată în Nature.
Informații cheie:
- acetaldehida afectează structura ADN-ului
- organismul are două metode de apărare împotriva acesteia (și, implicit, împotriva efectului mutagen al alcoolului)
- a doua metodă este mai recent înțeleasă, și are avantajul de a conduce mai rar la mutații cauzate de procesul de reparare
- prima cale de reparare elimină fragmentul anormal, a doua cale îl repară și îi redă funcționalitatea normală
O nouă linie de apărare împotriva mutațiilor cauzate de alcool
Alcoolul alterează genomul celulelor umane prin intermediul metabolitului său, acetaldehida. Este un compus foarte reactiv, care afectează ADN-ul prin apariţia fenomenului de crosslinking intercatenar (ICL – interstrand crosslinking) în structura lui. ADN-ul este format din două catene, cu structură în oglindă, conectate prin legături slabe, care se desfac cu ocazia transcripției și replicării ADN-ului. Compuși precum acetaldehida pot conduce la formarea de legături puternice între cele două catene (ICL), astfel împiedicând diviziunea celulei şi sinteza proteinelor. Totodată, acumularea secvenţelor ICL poate duce la moartea celulei sau transformarea acesteia într-o celulă canceroasă. Organismul are două metode pentru a repara aceste legături defectuoase.
Primul mecanism este unul deficitar și într-o boală ereditară (anemia Fanconi – FA – o boală genetică rară, cauzată de mutații în gene resposabile cu repararea ADN-ului, în cadrul căreia există imposibilitatea de a mai produce celule sanguine şi predispoziţia spre dezvoltarea cancerului). Acest mecanism acționează prin „excizia” fragmentelor ADN lezate. Acest mecanism este similar celui de reparare a ICL care apare drept răspuns la administrarea chimioterapiei cu cisplatin. În continuare, mecanismul prin care acetaldehida induce aceste modificări în structura ADN-ului este incomplet înțeles.
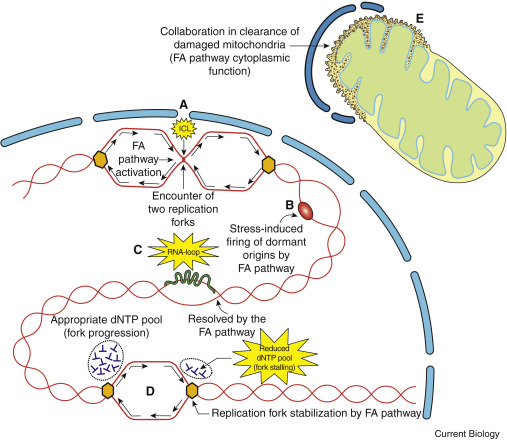
Prin studierea mecanismelor din cadrul FA, putem înțelege etapele prin care este menţinută integritatea ADN, și în cazul acetaldehidei:
A: Pasul iniţial este detectarea şi repararea ICL din cadrul ADN (care menţin catenele apropiate și împiedică replicarea ADN-ului);
B: Ca răspuns la stress-ul replicativ, anumite proteine ale căii FA colaborează în activarea regiunilor de ADN care declanșează replicarea;
C: Proteinele interacţionează în vederea eliminării unor hibrizi ADN-ARN cunoscuţi ca “Bucle R” – aceste structuri blochează furca de replicare a ADN-ului şi, dacă nu sunt reparate, cresc gradul de instabilitate genomică;
D: Furca de replicare este stabilizată, iar exonucleazele ADN împiedică degradarea acesteia;
E: Proteinele căii FA contrinuie și la clearance-ul mitocondriilor deteriorate (mitofagie): astfel, proteinele pot preveni acumularea speciilor reactive de oxigen, şi, ulterior, a altor degradări ADN.
Autorii studiului au identificat, de asemenea, o nouă cale mai rapidă, care „necesită furca de replicare, dar nu implică incizii ADN – în schimb, crosslink-ul format de acetaldehida însăşi este rupt”. Mai precis, polimeraza REV1 aparţinând familiei de ADN-polimeraze Y „realizează repararea fenomenului de crosslink, culminând într-un spectru mutaţional distinct”.
Cele 2 mecanisme diferă între ele: în calea FA, ADN-ul este tăiat pentru a îndepărta ICL (este secționat și eliminat chiar fragmentul în care s-a realizat crosslinkingul), în timp ce enzimele din calea nou descoperită taie chiar ICL (nu este eliminat fragmentul, ci legătura anormală dintre catene este desfăcută). Autorii menţionează că aceste rezultate „descriu căile de reparare a ADN-ului cu ICL, cauzate de un metabolit endogen, derivat din alcool şi identifică un mecanism independent de excizie”.
Studiul care a descris în detaliu cele două metode de apărare a utilizat extracte de proteine din ouăle unei specii de broaşte – Xenopus laevis. Au fost generate ICL, induse de acetaldehidă în structura ADN-ului, şi a fost studiat mecanismul de reparare în extractele din ouă de Xenopus.

Metabolismul alcoolului în organism
Peste 90% din alcoolul ingerat este metabolizat la nivelul ficatului (în cantităţi mai mici şi în sistemul digestiv, pancreas şi creier), un mic procent eliminându-se prin respiraţie, urină sau transpiraţie.
Există câteva căi de metabolizare, însă principalele două includ enzimele alcool-dehidrogenază (ADH) şi aldehid-dehidrogenază (ALDH). ADH metabolizează alcoolul la acetaldehidă – un compus toxic şi un cunoscut carcinogen; acetaldehida este apoi rapid metabolizată la un produs mai puţin activ, acetat, care apoi este descompus în alte ţesuturi, mai puţin în ficat, în apă şi dioxid de carbon pentru o eliminare mai uşoară. Au fost identificate mai multe izoenzime ale ADH, toate catalizând aceeaşi reacţie, însă cu eficienţă diferită. Acest aspect poate explica variabilitatea manifestărilor în rândul diferiţilor consumatori.
Pe lângă ADH, alte două enzime convertesc alcoolul la acetaldehidă: citocromul P450 (CYP2E1) (acţionează la nivelul ficatului doar în momentul în care s-a ajuns la un consum cronic de alcool, reacţia consumând energie) şi catalaza existentă în peroxizomii din interiorul celulelor din întreg organismul; la nivel cerebral, acetaldehida eliberată de către catalază are capacitatea de a se combina cu anumiţi neurotransmiţători şi de a forma compuşi presupuşi a sta la baza adicţiei consumatorilor.
Alcoolul afectează oamenii în mod diferit
Variaţiile inter-individuale în privinţa metabolizării au la bază mai mulţi factori printre care genetica, dimensiunea ficatului şi masa corporală. Izoenzimele menţionate anterior induc viteze de metabolizare diferite, iar acumularea produşilor în organism duce la efecte nedorite, inclusiv la dezvoltarea alcoolismului. O femeie cu o masă corporală similară cu a unui bărbat, în urma consumului unei cantităţi egale de alcool în aceleaşi circumstanţe, va avea o concentraţie mai mare de alcool în sânge. Odată cu înaintarea în vârstă, organismul produce mai puţina alcool-dehidrogenază şi este afectat de consumul unei cantităţi mai mici.
Apărare împotriva afectării ADN
Din fericire, fiecare celulă din corp are metode sau instrumente cu ajutorul cărora îşi poate repara această afectare a ADN-ului. Prima linie de apărare împotriva ICL cauzată de acetaldehidă este reprezentată de izoenzima ALDH2 care o descompune înainte ca aceasta să provoace daune. Cu toate acestea, această enzimă nu e prezentă în fiecare organism – aproape jumătate din populaţia asiatică şi mai mult de 2 miliarde de persoane la nivel mondial posedă o mutaţie în gena codificatoare pentru această enzimă. Neavând posibilitatea de a descompune acetaldehida, aceste persoane sunt predispuse la dezvoltarea cancerului având la bază consumul de alcool.
Legătura dintre alcool şi bolile umane, inclusiv cancerul
Efectele alcoolului pe termen scurt includ:
- Răniri, violenţe;
- Afectarea capacităţii de a conduce autovehicule;
- Intoxicaţii;
- Comportamente riscante;
- Complicații gestaționale: întreruperi spontane de sarcină sau afectarea fătului sau a nou-născutului;
Efectele pe termen lung includ:
- Hipertensiune arterială;
- Probleme de învăţare, de memorie, afectarea performanţelor şcolare și profesionale;
- Probleme sociale – scăderea productivităţii, pierderea locului de muncă;
- Afectări psihiatrice – depresie, anxietate, dependenţă;
- Cancer, care poate apărea în diferite organe: cancer mamar, oral, esofagian, hepatic, pancreatic, de colon.
Conform datelor statistice ale Organizației Mondiale a Sănătății, o proporție semnificativă de cazuri de cancer sunt atribuite în mod exclusiv consumului de alcool, ceea ce le încadrează în categoria cancerelor evitabile: în 2012, 5,5% din totalul diagnosticelor oncologice au fost atribuite alcoolului, și 5,8% din decese. Dintre tipurile de cancer, cel mai frecvent cancerul orofaringian și, respectiv, esofagian este cauzat de alcool: 36,7% și, respectiv, 44,7% dintre cazuri sunt cauzate de consumul excesiv de alcool.
Ultimul raport global al situaţiei consumului de alcool a fost publicat în 2018 de către Organizaţia Mondială a Sănătăţii, alături de o iniţiativă de a reduce consumul dăunător – SAFER.
Cu acest studiu, echipele au oferit o privire de ansamblu asupra procesului de reparare a ADN-ului. „Cunoaştem faptul că există multiple căi prin care organismul poate repara fenomenele de ICL în ADN”, a declarat co-autorul Puck Knipscheer, PhD, liderul grupului la Institutul Hubrecht. De asemenea, consideră că acest tip de cercetare poate determina o mai bună înţelegere a tratamentului cancerului cauzat de consumul alcoolului. „Însă înainte de a putea face asta, avem nevoie să ştim cu exactitate cum funcţionează acest mecanism inedit de reparare a ICL”.
Citeşte şi:
- STUDIU. Alcoolul provoacă modificări genetice ireversibile în ADN-ul celulelor stem, crescând riscul de apariție a cancerului
- Pan-Cancer Project: cel mai amplu proiect de medicină genomică realizat vreodată asupra mecanismelor moleculare implicate în apariția și evoluția cancerului. Care sunt principalele rezultate?
- Premiul Nobel pentru Fiziologie și Medicină 2019: descifrarea mecanismelor prin care celulele detectează și răspund la variațiile oxigenului

