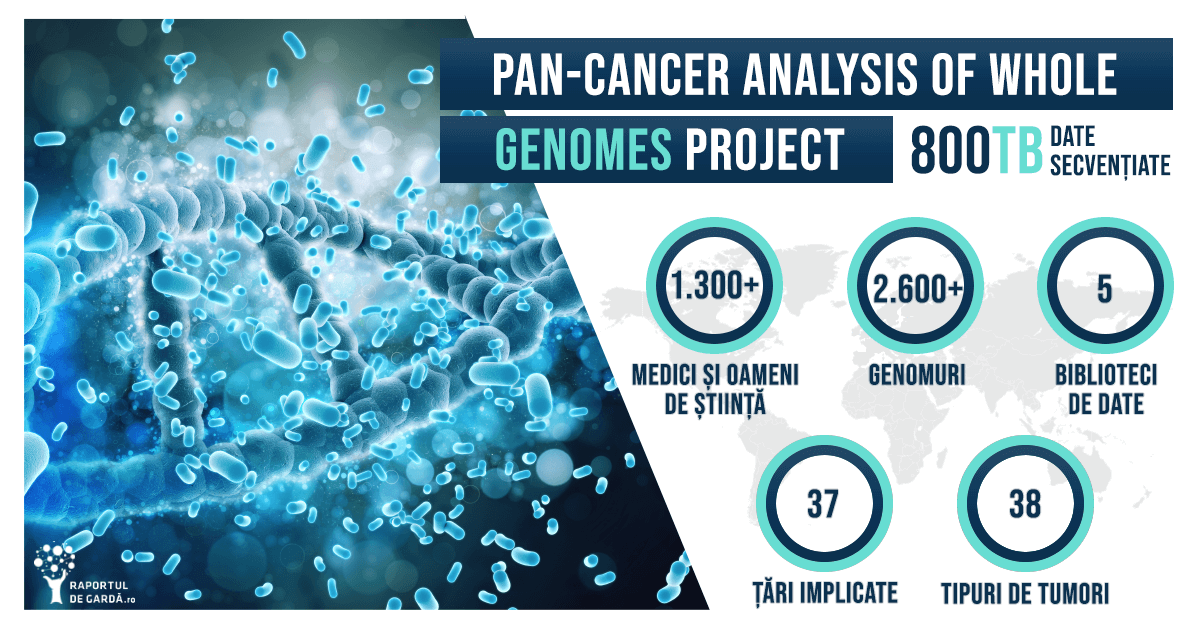
Pan-Cancer Project: cel mai amplu proiect de medicină genomică realizat vreodată asupra mecanismelor moleculare implicate în apariția și evoluția cancerului. Care sunt principalele rezultate?
Scopul medicinei de precizie este ca pacientul să primească tratamentul potrivit particularităților sale biologice. Cu toate acestea, în practică apar numeroase provocări. Acestea sunt explicate prin complexitatea biologică a cancerului. Care nu reprezintă o sigură boală. Există diferențe între tumori, între celulele care alcătuiesc tumora, între organisme și modul în care ele reacționează la mediu. Înțelegerea biologiei cancerului înseamnă mai mult decât descifrarea celor 3 miliarde de perechi de baze care alcătuiesc genomul uman, înseamnă integrarea acestui mesaj complex. Înseamnă mai mult decât surprinderea unei imagini la un moment dat, înseamnă un proces dinamic și imprevizibil.
Pe 5 februarie, 23 de articole științifice au fost publicate în Nature și în jurnale afiliate, reunind cea mai importantă analiză asupra mecanismelor moleculare implicate în cancer realizată vreodată. Peste 2600 de genomuri, reprezentând 38 de tipuri tumorale diferite au fost examinate în cadrul unui proiect fără precedent, Pan-Cancer Analysis of Whole Genomes Project (Pan Cancer Project). 1300 de experți din 37 de țări au contribuit la cea mai mare bază de date internațională asupra genomicii cancerului.
Publicarea Proiectului Genomului Uman în 2003 a însemnat prima bornă importantă pentru medicina personalizată – descifrarea setului de instrucțiuni care poartă mesajul care alcătuiește organismul uman. Cu toate acestea, lucrurile s-au complicat din acel moment. Doar 1-2% din genom codifica produși funcționali (proteine), iar această parte a fost numită exom. Majoritatea proiectelor de cercetare care au urmat în oncologie – The Cancer Genome Atlas (TCGA), proiecte realizate de International Cancer Genome Consortium (ICGC) – s-au concentrat pe studierea exomului.
Pan-Cancer Project continuă aceste demersuri și reprezintă o resursă comprehensivă care reunește cele mai importante mecanisme moleculare implicate în carcinogeneză descrise până acum. Ce informații se pot obține prin secvențierea completă a genomului tumoral? Cum funcționează partea din genom mai puțin explorată, regiunile necodante, care reprezintă de fapt 99% din genom ? Care sunt mutațiile cheie care determină apariția celor mai frecvente tipuri de cancere? Care sunt mutațiile care apar primele în evoluția cancerului? Acestea sunt doar câteva dintre întrebările pentru care încep să apară răspunsuri.
Tehnicile moderne de secvențiere a genomului, de analiză a transcriptomului reprezintă doar o parte din succesul proiectului. Acesta s-a datorat și altor 2 elemente cheie. Tehnologia este unul dintre ele: nu s-au folosit baze de date fragmentate ci s-a mizat pe folosirea unei platforme de cloud computing. Al doilea a fost colaborarea, împărtășirea datelor și lecții învățate de la experți din țări diferite. A fost analizat aproape fiecare genom tumoral disponibil din bazele de date publice de la începutul proiectului.
Colaborarea continuă, fiind lansate 16 grupuri de lucru care studiază diferite aspecte, de la cauzele cancerului, până la clasificări și evoluția bolii.
În țări precum Regatul Unit există proiecte la nivel național de secvențiere genomică pentru pacienții oncologici. Pan Cancer Atlas poate fi o resursă importantă pentru astfel de programe naționale de medicină genomică, constituind o „bibliotecă” pe care medicii o pot accesa și pot ghida tratamentul potrivit pentru un pacient.
Genomul cancerului este finit și poate fi caracterizat în detaliu, însă este complex
Cel puțin o mutație driver a fost identificată în toate tipurile tumorale analizate, iar mecanismele sunt variate. De la modificările unui singur nucleotid, la modificări ale unor fragmente întregi de cromozomi.
- 95% dintre tumorile analizate prezentau cel puțin o mutație driver, comparativ cu analiza exomului, prin care se identificau doar 67% dintre aceste mutații
- Fiecare tip de tumoră analizată prezenta în medie între 4 și 5 mutații driver
- Doar 13% dintre mutațiile driver proveneau din regiuni ale genomului necodante.
În ultimii 20 de ani, înțelegerea mutațiilor driver a fost un obiectiv major al lumii științifice, iar cercetările au demonstrat că există un număr limitat de astfel de mutații, însă combinațiile de mecanisme prin care interacționează sunt de ordinul zecilor de mii.
Din punct de vedere clinic, această descoperire se traduce prin extinderea numărului de persoane care ar putea beneficia de o terapie țintită și implicații multiple pentru cercetare.

Capacitatea unei populații de celule de a prolifera depinde de fenomene precum rata de diviziune și moartea celulară. Toate aceste sunt sub control genetic. Instabilitatea genomică este o caracteristică universală a celulelor tumorale. Aceasta influențează mai multe aspecte, de la mutații punctiforme, până la modificări structurale ample și anomalii epigenetice.
Mutațiile driver sunt acele anomalii care au un rol major în inițierea și în progresia dezvoltării tumorale. Mutațiile driver se regăsesc mai des la nivelul regiunilor codante ale genomului și mai frecvent au origine somatică. Restul genelor mutante sunt numite gene pasager (passenger genes), ele nu au un rol direct în fenomenul de carcinogeneză. Cu toate acestea, ele sunt importante pentru că pot deveni driver.
De ce doi pacienți care au aparent același tip de cancer nu răspund la fel la un anumit tratament?
Fiecare tip de tumoră poate prezenta mii de mutații la nivelul ADN-ului iar diferențierea dintre o mutație driver și o mutație pasageră poate fi dificilă. Există multe cazuri în care nu se identifică mutații driver cunoscute la nivelul exomului.
Noi mutații driver au fost identificate și la nivelul porțiunilor din genom care controlează expresia genică. Pan Cancer Atlas reprezintă cea mai cuprinzătoare analiză realizată vreodată asupra regiunilor necodante din genom, care de fapt reprezintă aproape 99% din acesta.
Genomul fiecărui pacient cu cancer este unic, însă există anumite anomalii care se repetă sub forma unor tipare moleculare. Unul dintre studiile din Pan Cancer Atlas s-a concentrat asupra regiunilor mai puțin explorate din genom, regiunile necodante. O echipă de la Princeton a realizat acest studiu care a inclus peste 2500 de pacienți. Rezultatele au arătat că:
- 93 de gene asociate cu mutații driver au fost identificate în regiunile necodante. Doar 19% dintre aceste gene erau cunoscute înainte de proiectul Pan Cancer Atlas
- Cele mai importante mutații au fost identificate aproape de gene implicate în fenomenul de splicing ( mesajul copiat din ADN în ARN în cursul expresiei genice conţine o succesiune de secvenţe necodante numite introni, care vor fi eliminate).
Astfel de tipare de anomalii genetice sunt însă specifice pentru anumite celule sau țesuturi. Mecanismele care țin de expresia genică sunt complexe. O mutație într-o regiune necodantă ar putea implica un efect cu totul diferit într-o celulă de la nivel pulmonar sau din alt organ. În acest context, cele 2500 de probe analizate în cadrul studiului nu sunt suficiente pentru a caracteriza fenomenele care apar în anumite tipuri de cancere, mai ales dacă discutăm despre boli rare. Accesul la date este soluția, realizare unor studii ample, care să includă mulți pacienți, pot permite identificarea cât mai multor dintre acestor aspecte.
„Pentru mine, cel mai șocant e să descoperim cât de diferit este genomul tumoral de la o persoană la alta. Vedem mii de combinații de mutații care pot determina apariția cancerului și peste 80 de procese diferite care generează mutațiile.” – Dr. Peter Campbell, cercetător în cadrul Pan-Cancer Atlas și expert Wellcome Sanger Institute
Evoluția în timp a modificărilor genomice în cancer
Deși inițial tumorile prezintă același tip de mutație driver, în timp apar noi anomalii. Toate acestea pot fi determinate de tipul de cancer, de alți factori genetici și factori care țin de stilul de viață al pacientului. Folosind modele computerizate s-au putut face determinări asupra cronologiei evenimentelor implicate în carcinogeneză. Modificările genetice apar cu mult timp înainte de dezvoltarea tumorii, iar caracterizarea acestora ar permite dezvoltarea de noi instrumente pentru diagnosticul precoce.
O echipă de experți de la Francis Crick Institute și European Molecular Biology Laboratory (EMBL) a realizat un studiu care a evaluat peste 2500 de tumori, reprezentând 38 de tipuri de cancere și a cercetat 47 de milioane de modificări genetice asociate acestora. S-a calculat de câte ori este copiată o singură anomalie și apoi replicată. Ulterior s-a identificat ordinea evenimentelor. Un număr mic de gene sunt responsabile de evenimentele inițiale care conduc la apariția cancerului
- 20% dintre mutații apar cu mult timp înainte de identificarea unui anumit tip de cancer, chiar decenii. Jumătate dintre modificări apar la nivelul a 9 gene specifice
Pentru 30 de tipuri de cancere s-au identificat modificări specifice și momentul din evoluția tumorală când acestea apar. De exemplu, anumite mutații apar precoce în cazul cancerului ovarian (anomalii la nivelul TP53) și în cazul glioblastomului (o copie a cromozomului 7)
Diviziunea celulară necontrolată și telomerele
O altă lucrare publicată în Nature arată că la nivelul a 22% dintre cele 2500 de tumori analizate apare un fenomen de instabilitate genomică numit cromotripsie (ruperea unor fragmente de ADN și rearanjarea într-o poziție anormală). Acest fenomen este semnificativ mai ales în cazul melanomului, de exemplu.
Telomerele sunt fragmente de ADN care protejează capetele cromozomilor. Pe măsură ce o celulă se divide ele se scurtează. În celulele stem se produce o enzimă numită telomerază care poate crește lungimea telomerelor, în schimb în restul celulelor diviziunile se opresc după aproximativ 50 de cicluri. Diviziunea necontrolată, care caracterizează celula canceroasă este posibilă prin interferarea acestor mecanisme – fie modifică direct expresia telomerazei, fie folosesc mecanisme alternative.
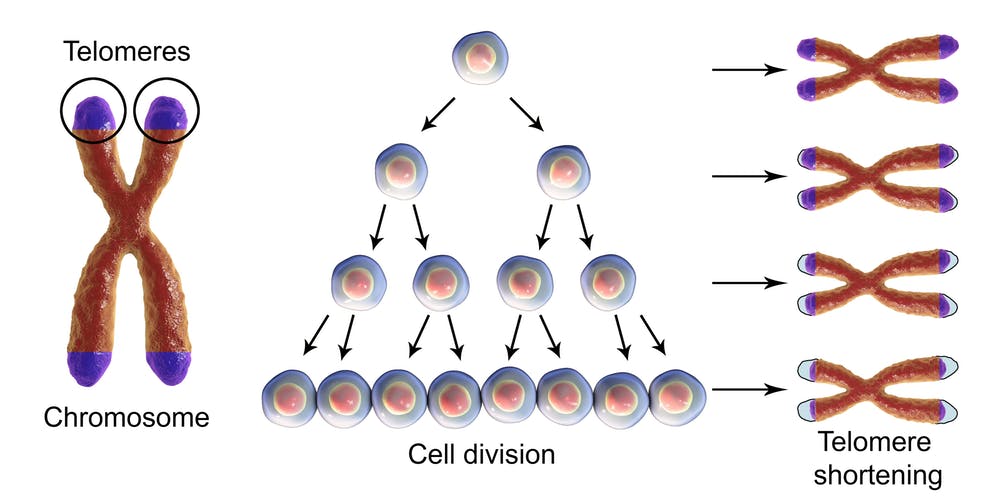
În Pan-Cancer Project este descris și acest fenomen. Un studiu realizat de experții de la German Cancer Research Center (DKFZ) a arătat că în cele mai multe cazuri de cancere studiate există o creștere a activității genei pentru telomerază însă nu apar modificări la nivelul genomului. O explicație ar fi legată de factorii epigenetici. În 13% dintre tumorile la care apar modificări la nivelul ADN care influențează activitatea telomerazei doar 64 de cazuri sugerau mecanisme alternative. În anumite tipuri de cancere, cum sunt cele de pediatrice unul dintre factori care determină agresivitatea bolii ține de mecanismele prin care cresc telomerele. În cazul meduloblastomului, dacă celulele folosesc mecanismele alternative menționate, prognosticul e nefavorabil.
Ce urmează?
8 milioane de oameni mor anual din cauza cancerului la nivel global. Incidența cancerului se estimează că va crește cu 50% în următorii ani. Pan Cancer Atlas reprezintă o resursă inestimabilă pentru comunitatea științifică și progresul în oncologie. Un scop important al proiectului este ca în viitor, pentru fiecare pacient oncologic să fie identificate mutațiile specifice care determină boală și integrate alături de informații precum cele legate de stilul de viață. Utilizarea tehnologiei cloud computing în cadrul acestui proiect a dovedit că pentru a obține rezultate colaborarea internațională posibilă și absolut necesară.
O provocare la momentul actual este completarea datelor genomice obținute în cadrul acestor proiecte cu date clinice. Realizarea unei biblioteci a mutațiilor caracteristice genomul cancerului nu este suficientă având în vedere complexitatea bolii. Următoarele demersuri ale ICGC se concentrează asupra integrării datelor genomice obținute folosind mai multe date de la fiecare pacient. Cu toate acestea, în viitor astfel de proiecte pot funcționa și se pot traduce prin valoare în practică doar dacă sistemele de sănătate se adaptează – sunt necesare elemente indispensabile precum crearea unor registre de calitate, noi standarde pentru protecția datelor.
Citește și
- #ReGândimMedicina: Biomarkerii în cancerul pulmonar. Dr Marius Geantă: „Inovația în medicină are valoare în momentul în care pacienții beneficiază de ea”
- Google Maps pentru cancer: „Este timpul să rescriem cărțile”. Cancerul va putea fi clasificat și tratat în funcție de profilul molecular, nu după localizare
- Unu-la-unu cu Dr. Marius Geantă: Dr. Mor Moscovitz, despre testarea comprehensivă genetică în cancerul pulmonar. Când și cum testăm biomarkerii?

