Tehnologia BiTE, o nouă dimensiune a imunoterapiei oncologice. Ce sunt anticorpii bispecifici și care este diferența față de terapia CAR-T?
În fenomenul de carcinogeneză, sistemul imun joacă un rol esențial, iar limfocitele T au fost studiate intens pentru dezvoltarea de noi terapii. Răspunsul antitumoral al limfocitelor T devine însă insuficient din cauza mecanismelor de scăpare de sub detecția imună. Astăzi putem combina proprietățile naturale ale limfocitelor T cu metodele de inginerie genetică și biotehnologie.
Dintre multiplele strategii explorate pentru stimularea sistemului imun să recunoască și să distrugă celulele tumorale, anticorpii bispecifici reprezintă o clasă nouă de terapii care câștigă teren datorită versatilității demonstrate, specificității față de ținte, costurilor mai reduse și metodelor accesibile de obținere și administrare.
Reprogramarea celulelor efectoare ale sistemului imun a deschis o nouă etapă în oncologie, odată cu succesul terapiilor celulare CAR-T, care sunt considerate cel mai înalt grad posibil de personalizare a tratamentului – modificarea genetică a limfocitelor T ale pacientului și reintroducerea lor în organism. Acestea au demonstrat rezultate fără precedent la pacienții cu neoplasme hematologice pentru care erau epuizate opțiunile terapeutice. Cu toate acestea, există încă provocări care țin de procesul elaborat de producere a acestor terapii și de obținerea unor remisiuni durabile.
Una dintre cele mai cunoscute abordări în imuno-oncologie este utilizarea anticorpilor monoclonali, proteine care se adresează mecanismelor ce permit celulelor imune să recunoască și să distrugă celulele transformate malign. În ciuda eficacității demonstrate, anticorpii monoclonali nu funcționează întotdeauna în monoterapie. Limitările țin de activarea unor căi moleculare alternative, modificările micromediului tumoral, exprimarea slabă a unor antigene de suprafață și alte mecanisme. În acest context, au apărut noi strategii, care să țintească moleculare complexe implicate în carcinogeneză.
Acum 30 de ani însă, a apărut ideea de a dezvolta anticorpi care să funcționeze ca o punte – să aducă celula imună și celula tumorală în contact. Tehnologia BiTE (Bispecific T cell Engager) scanează organismul și recrutează limfocitele T ale pacientului să recunoască și să atace celulele tumorale.
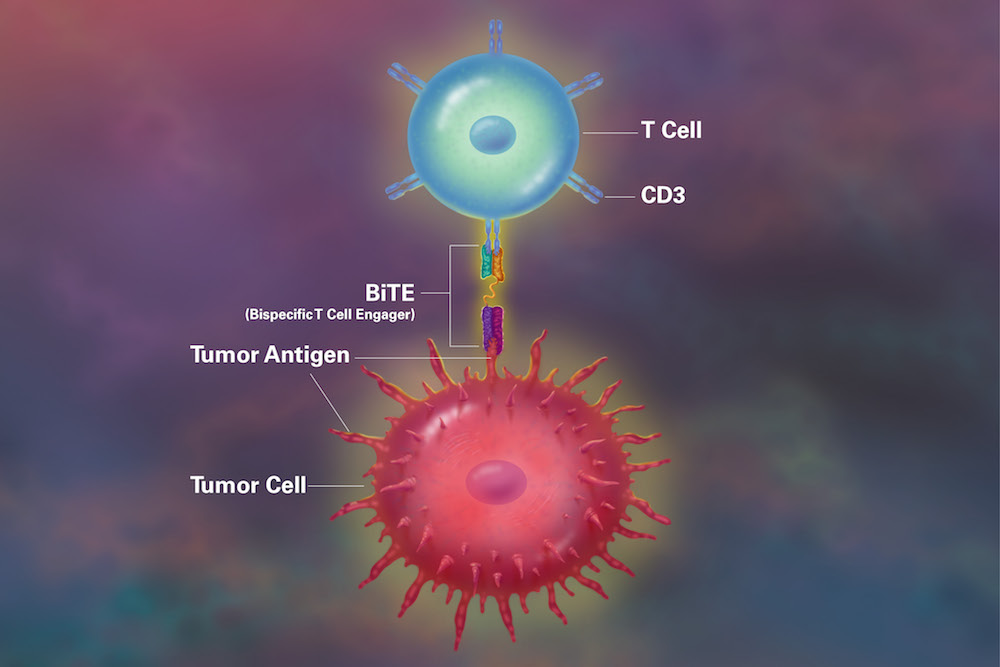
Cum funcționează tehnologia BiTE?
Anticorpii monoclonali sunt folosiți în oncologie pentru legarea de ținte specifice numite antigene – molecule care sunt mai numeroase pe suprafața celulelor canceroase decât pe suprafața celulelor normale. Prin legare de o anumită țintă apar diferite efecte folosite în scop terapeutic – distrugerea directă a celulei tumorale, marcarea ei pentru distrugere,
blocarea creșterii celulare.
Anticorpii bispecifici sunt proteine artificiale care pot ținti două antigene în același timp. Astfel ei se pot lega simultan de celula tumorală și pot recruta limfocitele T. BiTE reprezintă o clasă de anticorpi bispecifici care permit apropierea dintre o celulă T și o celulă tumorală.
Tehnologia BiTE se diferențiază prin capacitatea crescută de a induce moartea celulelor tumorale, activare a celulelor T dependentă de țintă, iar capacitatea de distrugere a celulelor canceroase se menține chiar și atunci când există un număr scăzut de limfocite T disponibile.
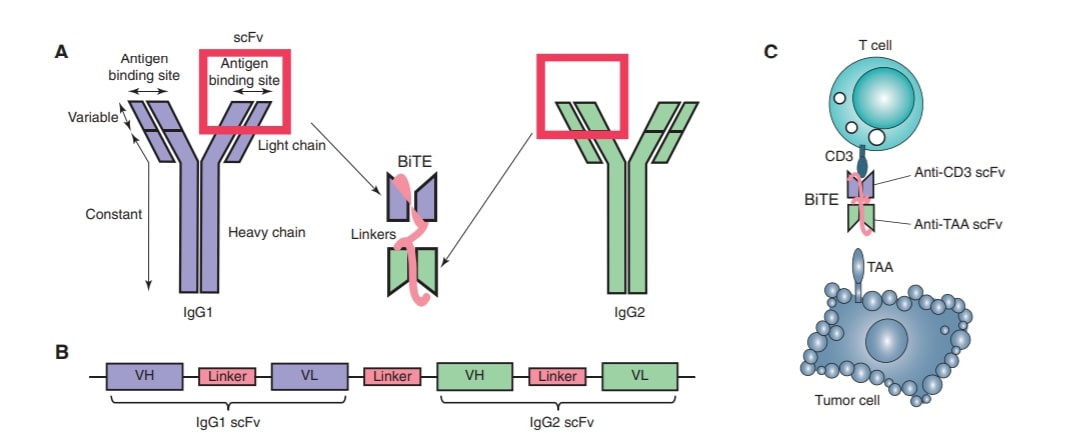
Blinatumomab este prima moleculă BiTE și primul anticorp cu specificitate pentru CD19 aprobat de FDA. În 2014 blinatumomab a fost aprobat în Statele Unite ale Americii pentru tratamentului leucemiei acute limfoblastice (LAL), în cazurile în care lipsește cromozomul Philadelphia. Blinatumomab permite limfocitelor T ale pacientului să recunoască limfocitele B transformate malign. O moleculă prezintă două zone de legare – unul pentru receptorul CD3 de pe suprafața limfocitului T și unul pentru CD19 de pe suprafața celulei canceroase.
Dr. Peter Kufer, Directorul departamentului dedicat Tehnologiei BiTE din cadrul Amgen Research este unul dintre cercetătorii care a contribuit la dezvoltarea acestei molecule. Dr. Kufer a explicat, într-un interviu pentru Raportul de Gardă, beneficiile aduse de această nouă tehnologie și diferențele dintre tehnologie BiTE și imunoterapiile care se află în atenția lumii științifice în ultimii ani, terapiile CAR-T:
„Ambele strategii se bazează pe celulele T, cele mai puternice celule de atac ale sistemului imun. Pentru a direcționa aceste celule împotriva cancerului trebuie să adăugăm ceva pe lângă capacitatea lor naturală direcționată împotriva celulelor canceroase. Multe celule T din organism nu sunt direcționate împotriva celulelor canceroase. Putem să le oferim receptori artificiali care să recunoască și să distrugă celulele canceroase, cum este în cazul terapiei CAR-T. Astfel sunt preluate celule T de la pacient și modificate genetic să exprime pe suprafața lor un receptor care le permite celulelor să recunoască celule canceroase. Acestea sunt modificate ex vivo, amplificate și infuzate pacientului.
Modul în care acționează BiTE este mai pasiv și nu presupune prelevarea limfocitelor T de la pacient. Principiul nu e diferit, dar practic, în cazul tehnologiei BiTE avem disponibile toate celulele T din organism, nu trebuie să le scoatem și să le modificăm. Reușim prin infuzarea acestor molecule adaptoare care scanează celulele. Trebuie să ne asigurăm că dacă ele găsesc celulele canceroase le recunosc și le distrug. De aceea, infuzăm structurile BiTE și ne asigurăm că administrăm o concentrație suficientă pentru o perioadă de timp adecvată pentru a permite celulelor T să acționeze”.
Administrare off the shelf
Timpul de înjumătățire scurt determină atât avantaje cât și dezavantaje ale terapiei. În ceea ce privește blinatumomab, toxicitățile legate de activarea limfocitelor T sunt reversibile în momentul întreruperii tratamentului. Necesitatea infuziilor continue se asociază însă cu probleme de complianță.
„În cazul tehnologiei BiTE întotdeauna poți opri infuzia. Asta înseamnă că poți controla mai bine efectele adverse. Pentru ca metoda să funcționeze ai nevoie de structura BiTE, de celula T și de celula tumorală. Dacă una din componente lipsește, nu se întâmplă nimic. Managementul efectelor adverse presupune în primul rând posibilitatea de oprire a infuziei. Un avantaj practic al tehnologiei BiTE este că efectul este reversibil și pot fi administrate „off the shelf”. Moleculele de tip BiTE nu trebuie administrate doar în centre speciale, ci ar putea fi accesibile mai simplu comunității medicale. Cel putin până acum, CAR-T sunt limitate la centre specializate” – Dr. Kufer
Killing the seed before it grows
„Cred că ambele modalități o să își găsească locul. Întrebarea este care e locul potrivit pentru fiecare strategie. Noi suntem de părere că principiul „anticipare și prevenție” (predict and prevent) este esențial” – Dr. Kufer
Boala minimă reziduală (MRD) definește prezența celulelor canceroase care rămân detectabile deși pacientul a atins anterior remisiunea conform evaluării convenționale – este dovada că boala încă există la nivel molecular. Pacienții cu LAL care prezintă MRD după chimioterapie nu au un prognostic favorabil. LAL este primul tip de cancer în care evaluarea precoce a răspunsului la terapie cu ajutorului MRD s-a dovedit esențială în ghidarea răspunsului terapeutic.
Blinatumomab a determinat creșterea supraviețuirii pacienților cu LAL și în 2018 FDA a extins aprobarea, acesta reprezentând primul tratament pentru pacienții cu MRD. Aprobarea a venit în urma studiului BLAST, cel mai mare studiu care a evaluat pacienți cu LAL cu boală minimă reziduală și a demonstrat eficacitatea blinatumomab.
„O prioritate este identificarea pacienților cu boală minimă reziduală, ceea ce îi face susceptibili să dezvolte un anumit tip de cancer. Killing the seed before it grows (A distruge sămânța înainte să crească) – aceasta este cheia. Cred că ideal ar fi ca abordarea terapeutică să nu se adreseze doar stadiilor avansate. Trebuie să ne concentram pe liniile de tratament din stadii mai puțin avansate” – Dr. Kufer

Strategiile combinate
Este dificilă realizarea unei comparații între noile imunoterapii care apar, datorită mecanismelor diferite prin care acționează. Dr. Kufer atrage atenția asupra faptului că pe măsură ce noi terapii apar, acestea nu se exclud, ci strategiile combinate își demonstrează din ce în ce mai mult eficacitatea. De asemenea, abordarea trebuie individualizată în funcție de caz.
„Imunoterapia, comparativ cu chimioterapia, nu este genotoxică, este o opțiune mai bună la pacienții mai tineri, unde scopul este vindecarea. În cazul LAL , chimioterapia a funcționat o perioadă, dar cu cât ai mai multe tratamente te gândești la efecte adverse. Cred că este rezonabil ca terapiile mai putin genotoxice să fie primele”.
„Pe termen lung trebuie să ne gândim la secvența de pași în funcție de caz. Ce faci mai întâi? Îmi imaginez că variantele de tratament reversibile, mai puțin invazive, potente, vor fi administrate mai devreme decât cele ireversibile, greu de controlat. Scopul e să ne adaptăm”.
Noi generații de imunoterapii – în prim plan la ASH 2019
Anticorpii bispecifici au fost în prim plan și în cadrul Întâlnirii Anuale a Societății Americane de Hematologie. Unul dintre studiile prezentate la congres a demonstrat că mosunetuzumab determină răspunsuri susținute la pacienții limfom non-Hodgkin, care nu au răspuns la multiple linii de tratament și care au prognostic nefavorabil. Tratamentul a determinat remisiuni complete și durabile inclusiv la pacienții cu progresie a limfomului după terapia CAR-T.
Citește și:
- #ASH19. Mosunetuzumab, un anticorp bispecific, determină răspunsuri susținute în limfomul non-Hodgkin, chiar și la pacienții care nu au răspuns la terapia CAR-T
- ASH19. Terapia CAR-T anti-BCMA determină rate crescute de răspuns în mielomul multiplu refractar sau recidivant
- #ASH19. Terapia CAR-T de nouă generație, îndreptată către două ținte moleculare: răspuns complet de lungă durată în mielomul multiplu recidivant sau refractar

