#ASH19. Noi perspective pentru creșterea eficacității terapiilor genice pentru hemofilia A și B
În întreaga lume, se estimează că doar 30% dintre bolnavii de hemofilie au acces la terapie de substituție. Terapia genică permite producerea factorului de coagulare care lipsește sau care este în cantități insuficiente în organism. Una dintre provocările în dezvoltarea unei terapii genice este răspunsul imun îndreptat împotriva vectorului utilizat.
În cadrul Întâlnirii Anuale a Societății Americane de Hematologie (ASH 2019), au fost prezentate studii care au evaluat prevalența anticorpilor neutralizanți, precum și posibile soluții pentru depășirea acestei limitări care face ca mulți pacienți să nu poată fi incluși în studiile clinice.
Majoritatea producătorilor folosesc virusuri adeno-asociate (AAV). Prevalența anticorpilor neutralizanți împotriva anumitor subtipuri ale virusului ajunge până la 70% în populația generală. Mai mult decât atât, organismul poate dezvolta anticorpi pentru a neutraliza vectorii folosiți.
Unul dintre studiile prezentate la ASH 2019 a înrolat 194 de pacienți cu hemofilie A și 48 cu hemofilie B, cu vârste cuprinse între 18 și 75 de ani, din Statele Unite ale Americii și Europa. Rezultatele arată că 50% dintre aceștia aveau anticorpi neutralizanți împotriva AAV2, responsabil de cele mai frecvente infecții, dar și împotriva AAV5 sau AAV8. 40% dintre pacienți aveau anticorpi împotriva tuturor celor 3 tipuri de vectori virali. Aceste categorii de pacienți nu sunt incluse în studiile care evaluează terapii genice.
Într-un alt studiu s-a oferit și o posibilă soluție pentru această problemă. Un sistem care elimină anticorpii AAV8 din plasma pacienților prin afereză. Sângele este prelevat de la pacienți și plasma este separată de celelalte elemente, apoi trece printr-o coloană specială care preia anticorpii, iar ulterior este administrată pacientului.
Sistemul prezintă o coloană specială (immune adsorption column – IAC), care are un strat de capside tip AAV8 ce pot preleva anticorpii. Sistemul IAC este destinat pacienților care prezintă un răspuns imun împotriva AAV8. Acesta ar permite și re-administrarea tratamentului.
Se estimează că în următorii 5 ani, între 10 și 20 de terapii genice vor fi aprobate anual. Hemofilia a reprezentat una dintre cele mai importante candidate pentru terapia genică și datele arată că în 2020 ar putea fi aprobat primul tratament de acest tip pentru hemofilia A.
Scopul terapiei genice este administrarea unui tratament o singură dată, cu efect pe termen lung, și eliminarea necesității unui tratament cronic pentru acești pacienți. Studiile efectuate până acum raportează o activitate a factorului de coagulare normală sau aproape normală și reducerea ratelor anuale de sângerare cu aproape 90%.
În terapia genică se folosește un vector viral care nu cauzează o infecție, dar care transportă gena care poartă instrucțiunile pentru producerea factorului de coagulare care lipsește. Majoritatea terapiilor aflate în dezvoltare folosesc capside bazate pe virusuri adeno-asociate (AAV – adeno associated virus). Capsida reprezintă învelișul proteic, în care se găsește materialul genetic al unui virus.
Expunerea la AAV nu determină boli cunoscute la om, însă apar anticorpi și un răspuns imun celular îndreptat împotriva capsidelor. Acest fenomen blochează livrarea genei de interes și face terapia ineficientă.
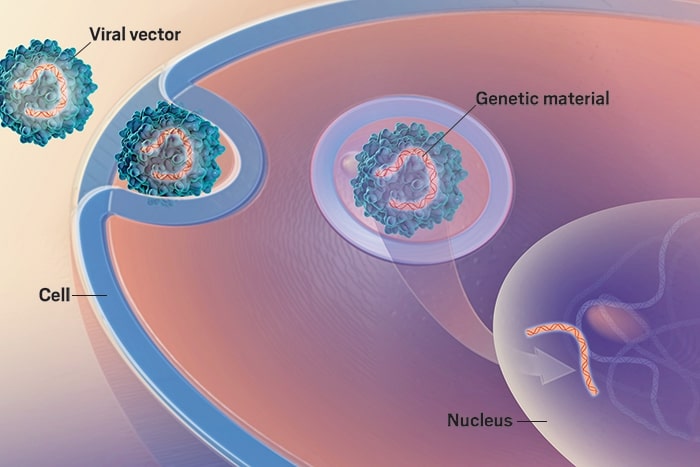
Vectorii adeno-asociați au fost descoperiți acum jumătate de secol. AAV infectează oamenii, însă nu sunt raportate cazuri de boală, iar comparativ cu alți vectori, răspunsul imun este ușor – este ideal pentru administrarea in vivo. Vectorului îi lipsește ADN-ul viral, fiind practic constituit din nanoparticule bazate pe proteine care traversează celula și livrează gena de interes în nucleu.
AAV este o metodă preferată în acest moment pentru că au capacitate de a infecta o gamă largă de celule, răspunsul imun este ușor, nu depinde de celulele aflate în diviziune, nu se integrează în genomul gazdei și astfel riscul de mutageneză inserțională este redus.
Organismul dezvoltă, însă, răspunsuri imune împotriva AAV și acesta este un motiv pentru scăderea eficienței terapiei.
- Pe de o parte, pot exista anticorpi preexistenți împotriva proteinelor din capsidă, ceea ce limitează transducția – prezența de anticorpi neutralizanți preexistenți blochează transducția în momentul administrării intravasculare;
- Pe de altă parte, pot apărea răspunsuri imune celulare întârziate și acestea au ca țintă celulele în care s-a realizat transducția, ceea ce poate scădea expresia factorului.
Potențiale strategii în aceste cazuri includ plasmafereza, imunosupresia, folosirea de serotipuri cu prevalență mai mică, administrare localizată. O strategie alternativă este scăderea dozei vectorului, care nu a fost asociată cu apariția unui răspuns imun celular, și poate să determine un nivel semnificativ de factor IX. Factorul cu specificitate crescută, cum este factorul IX Padua, a demonstrat rezultate promițătoare. Specificitate acestuia este de 8-12 ori mai mare.
Dezvoltarea de noi strategii pentru terapiile genice – tratarea imunității preexistente îndreptată împotriva AAV, scăderea dozelor, descoperirea de noi vectori – reprezintă condiții esențiale pentru asigurarea unor opțiuni curative funcționale pentru pacienți.
Demonstrarea siguranței terapiilor genice și a efectului pe termen lung va avea un rol major în alegerea opțiunii terapeutice. Având în vedere că deja există pe piață produse cu timp de înjumătățire extins, precum și terapia cu emicizumab, care se poate administra subcutanat, ceea ce reduce semnificativ povara bolii, pacienții pot opta pentru aceste variante până când terapiile genice își vor dovedi în timp eficiența. Demonstrarea valorii acestor terapii va fi un punct cheie, luând în considerare prețul ridicat cu care se așteaptă să ajungă pe piață și faptul că deja există terapii care ameliorează calitatea vieții pacienților.
Citește și:
- State of Innovation 2019: Schimbări majore în managementul hemofiliei – personalizarea tratamentului folosind aplicațiile mobile
- Impactul socio-economic al hemofiliei în România
- FDA aprobă primul medicament din ultimii 20 de ani pentru hemofilia A cu inhibitori

