Cum se dezvoltă bacteriile patogene multirezistente în apele reziduale? Noi strategii de combatere a rezistenței la antimicrobiene
Microorganismele care produc molecule de antibiotic există cu mult timp înainte de apariția primilor agenți antimicrobieni. Astfel, capacitatea multor bacterii din mediu de a se proteja de antibiotice nu este nouă. Însă, de la introducerea antibioticelor în uzul medical, bacteriile patogene au acumulat din ce în ce mai multe gene de rezistență. Folosirea antibioticelor pe scară largă, automedicația și tratamentul incorect, de scurtă durată, cu aceste medicamente a extins semnificativ gama de specii multirezistente. Eșecul în prevenirea și tratarea unor boli infecțioase a condus la o problemă de sănătate publică majoră din ultimii 50 de ani – rezistența la antimicrobiene.
În mai puțin de un secol, misiunea de combatere a bolilor infecțioase a trecut de la momente cheie precum descoperirea antibioticelor, la o adevărată criză de sănătate publică provocată de pierderea eficacității acestora și nevoia de a identifica noi strategii pentru a soluționa rezistența la antimicrobiene. Fără intervenții majore, până în 2050 se estimează că s-ar putea înregistra 10 milioane de decese anual din această cauză, depășind mortalitatea cauzată de cancer, iar economia globală ar fi, de asemenea, afectată prin creșterea costurilor asociate asistenței medicale.
Pe 7 aprilie este Ziua Mondială a Sănătății, care marchează, în 2023, aniversarea de 75 de ani a Organizației Mondiale a Sănătății, prilej pentru a recunoaște progresele realizate în domeniul sănătății publice. Din 1948, țările au fost unite de scopul comun de a crea o lume în care fiecare să își atingă potențialul pentru sănătatea și bunăstarea cetățenilor. Pandemia COVID-19 a demonstrat cât de ușor poate să se răspândească la nivel global un agent infecțios, dar și cât de multe instrumente inovatoare există, de fapt, neutilizate la capacitate maximă pentru beneficiul societății.
Rezistența antimicrobiană este un răspuns evolutiv al microorganismelor care poate avea consecințe vitale asupra oamenilor. Deși bacteriile pot dezvolta rezistență prin mutații spontane, acestea au și capacitatea de transfer direct de gene între specii (transfer orizontal), ceea ce facilitează „colaborarea” dintre ele pentru dezvoltarea rapidă a mecanismelor de rezistență. Caracterizarea mecanismelor de apariție a rezistenței la antimicrobiene a progresat semnificativ datorită tehnologiilor de analiză moleculară avansată. Acestea facilitează înțelegerea interacțiunii dintre agenții patogeni, genele de rezistență și elementele genetice mobile, precum și a interacțiunii cu mediul, cu oamenii și animalele. Accesibilitatea metodelor de secvențiere a întregului genom și analizele de metagenomică pot informa astăzi, în timp real strategii de sănătate public, dezvoltarea de noi metode de diagnostic, tratament a infecțiilor multirezistente și optimizarea vaccinurilor.
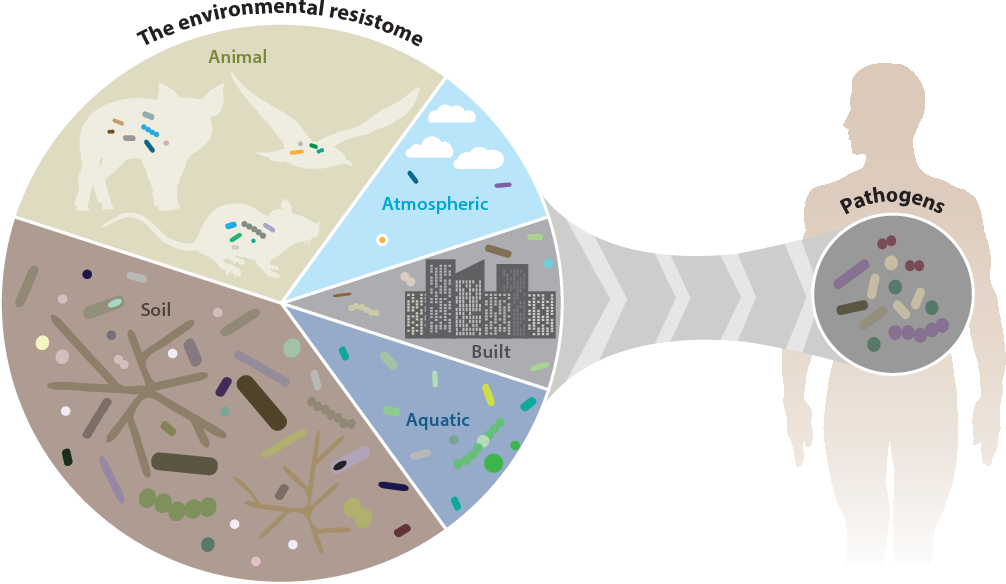
Apele uzate, mediul ideal pentru dezvoltarea rezistenței antimicrobiene
Ecosistemele acvatice reprezintă unul dintre punctele cheie în care se dezvoltă rezistența antimicrobiană. Din vremuri străvechi se practica eliberarea în mediu a apelor reziduale care conțineau diverse substanțe: de la combustibilii și substanțele toxice din al Doilea Război Mondial, până la compuși chimici folosiți în medicina umană, veterinară sau agricultură. Apele reziduale conțin antibiotice, dezinfectanți, metale și multe molecule toxice cu activitate antimicrobiană, care au favorizat dezvoltarea genelor de rezistență.
Un studiu realizat la Universitatea Gothenburg, în Suedia, a demonstrat contribuția mult mai mare decât se știa până acum a apelor reziduale pentru dezvoltarea mecanismelor de rezistență antimicrobiană. Au fost testate sute de probe din diferite medii și s-a descoperit că toate aceste specii se dezvoltă mai ales în apele reziduale, și nu atât de mult la nivelul microbiomului uman sau animal. Deși apele uzate conțin reziduuri de antibiotice, acestea nu sunt suficiente pentru dobândirea rezistenței.
Autorii atrag atenția că pentru combaterea rezistenței antimicrobiene nu este suficientă prevenirea răspândirii bacteriilor aflate deja în circulație, ci ar trebui intervenit pentru combaterea apariției unor specii noi. Tot mai multe studii demonstrează că în mediul înconjurător există multiple surse pentru apariția de noi gene de rezistență cu capacitatea de a se transmite între specii. Poluarea mediului cu antibiotice nu face decât să favorizeze acest proces.
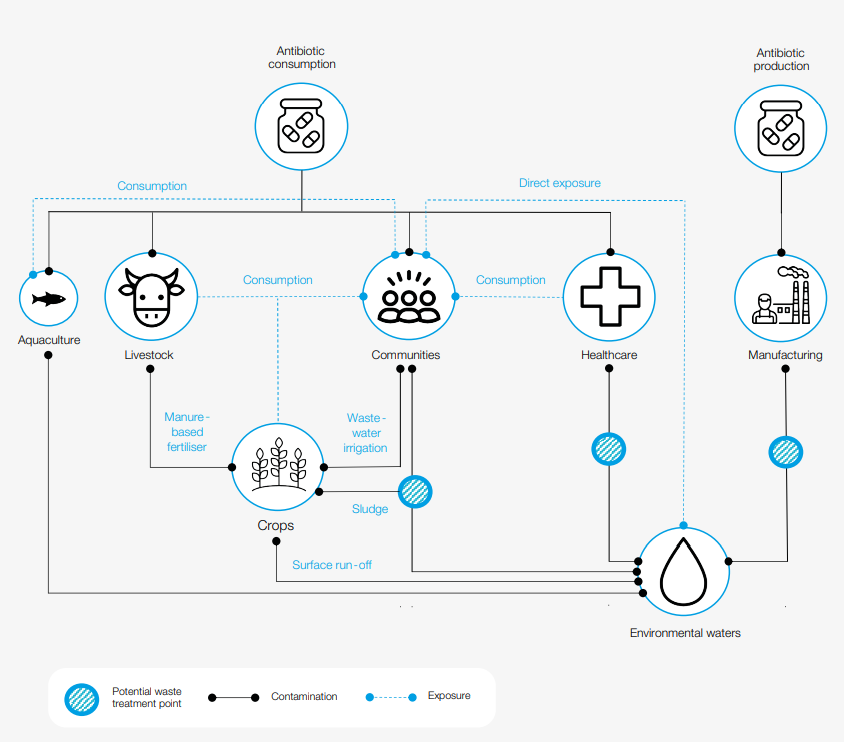
Supravegherea genomică pentru monitorizarea agenților infecțioși în timp real
Pandemia COVID-19 a reprezentat și primul moment în istorie când tehnologia a permis monitorizarea evoluției unui agent patogen în timp real prin secvențiere genomică și a facilitat dezvoltarea aplicațiilor genomicii în epidemiologie și boli infecțioase.
În ultimii 3 ani, s-au acumulat dovezi științifice care justifică rolul monitorizării rezistenței la antimicrobiene, de rutină, prin secvențierea genomică a probelor din ape uzate. De exemplu, un studiu publicat recent în Nature, arată că monitorizarea genomică nu ar trebui să fie folosită doar în contextul pandemiilor. Aceasta ar trebui să se aplice în mod continuu și infecțiilor endemice și epidemiilor silențioase, inclusiv pentru monitorizarea rezistenței la antimicrobiene. De asemenea, sunt necesare strategii adaptate pentru fiecare zonă, deoarece aplicarea aceleiași metode poate avea efecte diferite în funcție de particularitățile geografice. Indiferent de intervenția aleasă, analiza genomică a apelor uzate poate permite monitorizarea regională a rezistenței la antimicrobiene, a variantelor, a diversității din rezervoarele urbane.
În 2021, pornind de la recomandările ECDC în contextul pandemiei COVID-19, Centrul pentru Inovație în Medicină a propus setarea unui sistem de supraveghere prin secvențiere genomică a SARS-CoV2 în România, care include și monitorizarea apelor reziduale.
Numărul de gene de rezistență la antibiotice din microbiomul intestinal este puternic influențat de trendurile naționale de consum
Folosirea antibioticelor în afara indicațiilor medicale determină efecte negative asupra microbiomului, crescând numărul de gene de rezistență la aceste tratamente, care se răspândesc foarte ușor în populație, independent de stilul de viață al oamenilor. Chiar și o persoană sănătoasă, care nu a luat antibiotice prea des, este expusă la microorganisme de la oamenii sau animalele cu care interacționează, ceea ce facilitează modificarea compoziției microbiotei. Datele provin dintr-un nou studiu realizat de Earlham Institute din Norwich. Acest fenomen de transfer al genelor în populație (transfer orizontal) și între specii are un rol esențial în dezvoltarea rezistenței la antibiotice. Înțelegerea particularităților fiecărei țări ar putea aduce informații importante pentru strategiile de sănătate publică.
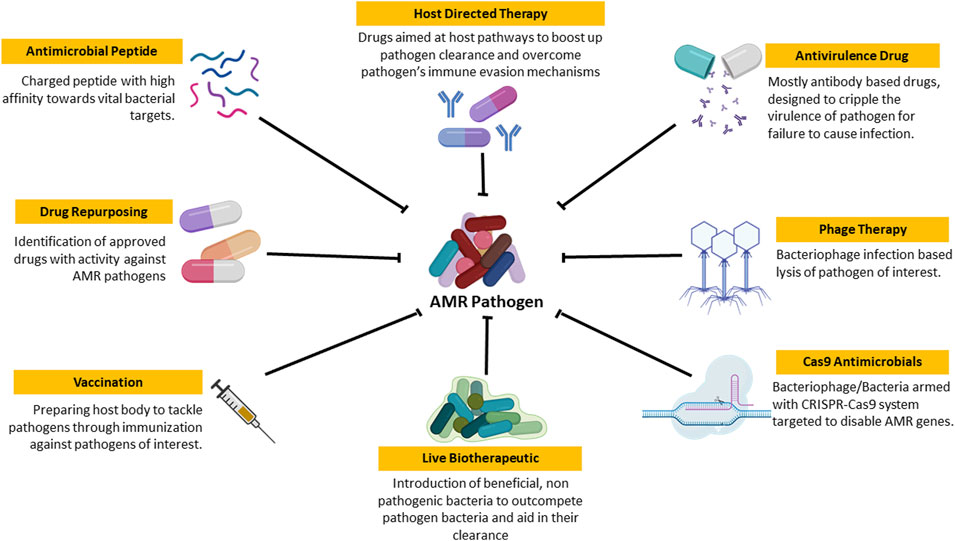
Soluții inovatoare pentru combaterea rezistenței antimicrobiene
Anumite specii bacteriene au devenit multidrog rezistente, cum este, de exemplu, MRSA (Staphylococcus aureus meticilino-rezistent), VRSA (Staphylococcus aureus rezistent la vacomicină), Clostridium difficile, Mycrobacterium Tuberculosis. În acest context, sunt necesare noi tipuri de strategii pentru dezvoltarea de tratamente eficiente în combaterea infecțiilor bacteriene.
De la Premiul Nobel pentru Chimie la o nouă generație de medicamente: antibioticele care își schimbă configuranția.
Premiul Nobel pentru Chimie a fost acordat în 2022 pentru dezvoltarea unei tehnici care a revoluționat dezvoltarea de molecule noi în scop terapeutic. Click chemistry este o metodă prin care anumite molecule pot fi combinate mai eficient pentru a crește capacitatea de fabricare pe scară largă. Spre deosebire de metodele tradiționale de a dezvolta medicamente, care implică sintetizarea unui număr mare de compuși și testarea activității acestora, în cazul chimiei click, anumite reacții pot fi combinate ca piese de puzzle fără nevoia unor pași adiționali de purificare sau sinteză complexă.
Folosind această tehnologie, Prof. John E. Moses de la Cold Spring Harbor Laboratory (CSHL) a creat un nou tip de antibiotic, o moleculă care își poate schimb ușor structura prin rearanjarea atomilor. Ideea a pornit de la modelul tancurilor, care au turnul mobil, capabil de mișcări rotative care se orientează după țintă. Pe același principiu, a fost identificată o moleculă – bulvallene – cu o structură versatilă care poate adopta milioane de configurații. Prin atașarea acestei molecule de vancomicină, un antibiotic folosit pentru o gama largă de infecții, se obține un compus care își poate schimba structura în funcție de țintă și poate elimina infecții potențial fatale, fără apariția rezistenței.
Tratamentul personalizat al infecțiilor rezistente la antibiotice folosind noi specii de virusuri care atacă bacteriile
În timpul pandemiei Covid-19, din cauza restricțiilor impuse de autorități care limitau și accesul în laborator, o echipă de studenți de la Universitatea din Danemarca și-a desfășurat studiile în natură. Cu această ocazie au fost descoperite 5 noi tipuri de virusuri care erau până acum necunoscute lumii științifice. Doar pentru una din variantele virale a fost realizată secvențierea genomului, iar rezultatele au fost publicate în Microbiology Resource Announcements.
Fyn8 este numele atribuit bacteriofagului (un tip de virus care atacă bacterii) recent identificat, despre care s-a demonstrat că poate ataca și distruge Pseudomonas aeruginosa, o bacterie care se găsește în sol și apă, însă care a dezvoltat rezistență la antibiotice și reprezintă o problemă importantă de sănătate publică, fiind implicată în numeroase infecții nosocomiale.
Primul „medicament viu” pentru combaterea infecțiilor pulmonare rezistente la antibiotice
Biotehnologia oferă o nouă soluție pentru combaterea rezistenței la antibiotice, care se bazează chiar pe modificarea genetică a unei bacterii. Tratamentul presupune utilizarea unei forme modificate a bacteriei Mycoplasma pneumoniae, fără capacitate de a cauza boală, însă cu noi proprietăți: capabilă atace o altă bacterie, Pseudomonas aeruginosa, o cauză importantă de infecții respiratorii nosocomiale și decese intraspitalicești. Rezultatele sunt publicate în Nature Biotechnology.
Citește și
- Podcast #știința360. Dr. Marius Geantă, despre monitorizarea de rutină a rezistenței la antimicrobiene prin secvențierea genomică a apelor uzate
- INTERVIU. Prof. Dr. Codruț Sarafoleanu: când luăm antibiotice? Tratarea răcelilor comune în sezonul rece

