Implementarea testării NTRK în sistemul de sănătate din România – recomandări Centrul pentru Inovație în Medicină
Tehnologia actuală permite o caracterizare de rezoluție înaltă a cancerului, dincolo de localizare, care merge până la descifrarea combinațiilor de mutații genetice și mecanismelor moleculare chiar și de la nivelul unei singure celule canceroase. Aprobările de terapii pentru indicații independente de localizarea tumorală (tumor agnostic) au marcat o nouă fază a dezvoltării de medicamente pe baza biomarkerilor. Acestea impun regândirea modului în care este abordat cancerul și sunt un pas important pentru atingerea potențialului medicinei personalizate.
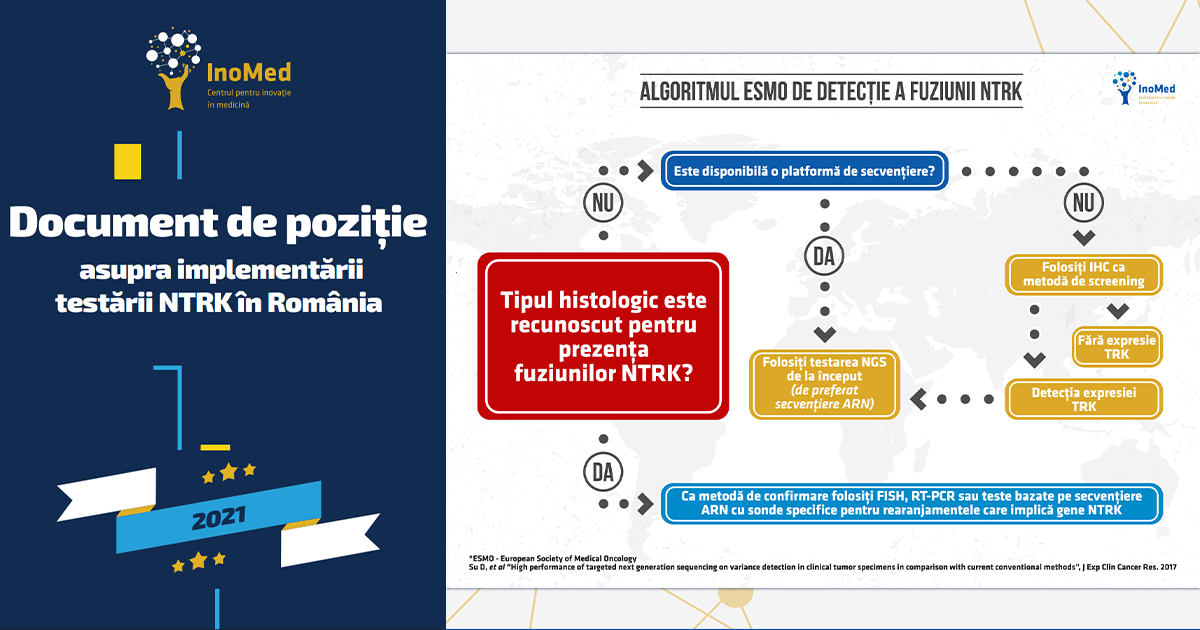
Cu fiecare nou tratament oncologic aprobat, testarea biomarkerilor pentru selectarea tratamentului potrivit pentru pacientul potrivit devine fundamentală. Centrul pentru Inovație în Medicină a lansat recent un document de poziție asupra Implementării testării NTRK în sistemul de sănătate din România, care ar putea reprezenta un model pentru medicina personalizată.
Un raport publicat la începutul anului demonstra că deși în România au intrat pe piață și au fost rambursate tot mai multe terapii țintite, lipsa accesului la diagnosticul de precizie a făcut ca această disponibilitate a terapiilor să nu se reflecte în supraviețuirea pacienților.
Terapiile de tip tumor agnostic sunt diferite de tratamentele oncologice clasice, acestea având ca țintă anomalii genomice, indiferent de organul și țesutul în care se identifică tumora. Cancerul este înțeles din ce în ce mai mult ca o boală a genomului, iar impactul asupra sistemului de sănătate este semnificativ. Asigurarea accesului pacienților la terapii inovatoare implică transformări pe mai multe planuri: infrastructura pentru diagnostic, mecanismele de acces și rambursare, ghiduri și informare.
Luând în considerare particularitățile diagnosticului NTRK și ale medicamentelor de tip tumor-agnostic, din punctul de vedere al reglementării, accesului pe piață și al implementării în sistemul de sănătate și în practica medicală, documentul de poziție cuprinde următoarele recomandări:
- Recunoașterea medicinei personalizate prin Strategia Națională de Sănătate 2021-2027;
- Elaborarea Planului Național pentru Controlul Cancerului în concordanță cu Planul European de Luptă împotriva Cancerului, inclusiv menționarea rolului medicinei personalizate (de precizie);
- Inițierea, derularea și finanțarea unui subprogram pentru testarea biomarkerilor (inclusiv NTRK) în cadrul Programului Național de Oncologie derulat și finanțat de CNAS;
- Crearea unei rețele naționale de laboratoare de referință pentru testarea biomarkerilor prin metodele recomandate de ghidurile și protocoalele internaționale, în condițiile asigurării calității prin controale interne și externe;
- Crearea unor board-uri moleculare multidisciplinare, în care să fie reprezentate specialitățile medicale relevante;
- Elaborarea unui protocol unic de testare la nivel național pentru NTRK;
- Implementarea de proiecte educaționale pe tema biomarkerilor și a medicinei personalizate în oncologie, adresate medicilor și pacienților;
Biomarkerii tissue agnostic
În oncologie, medicina de precizie se referă la utilizarea combinată a unor metode diagnostice și terapeutice pentru beneficiul unui subset de pacienți ale căror tumori prezintă modificări genomice specifice care schimbă biologia celulelor și conduce la căi de semnalizare potențial acționabile. Un biomarker este o „caracteristică ce poate fi măsurată obiectiv și evaluată ca un indicator al unui proces biologic normal, patologic sau al unui răspuns farmacologic la o intervenție terapeutică”.
MSI (microsatellite instability) a fost primul biomarker care a condus la aprobarea unui medicament oncologic (pembrolizumab, un inhibitor al punctelor de control) pentru o indicație tumor-agnostic (independent de localizarea tumorii). Fuziunile NTRK (neurotrophic tyrosine receptor kinase) reprezintă al doilea biomarker de tip tissue-agnostic ce primește aprobare la nivel internațional. Rearanjamentele cromozomiale care implică genele NTRK1, NTRK2, NTRK3 au fost identificate drept ținte acționabile mai multe tipuri de cancere, care apar atât la adulți, cât și în populația pediatrică.
Rolul fuziunilor NTRK în cancer
Genele NTRK 1, 2 și 3 codifică o familie de receptori tirozin kinazici cu un rol important în dezvoltarea celulelor nervoase (TrkA, TrkB și TrkC). Aceste proteine sunt exprimate în cursul dezvoltării embriologice și în sistemul nervos al adultului. Fiecare receptor are o anumită afinitate față de diferite tipuri de neurotrofine (o familie de factori de creștere importantă pentru funcționarea sistemului nervos). Liganzii determină activarea unor căi de semnalizare, dintre care cele mai importante sunt PLC, Ras/MAPK și PI3K.
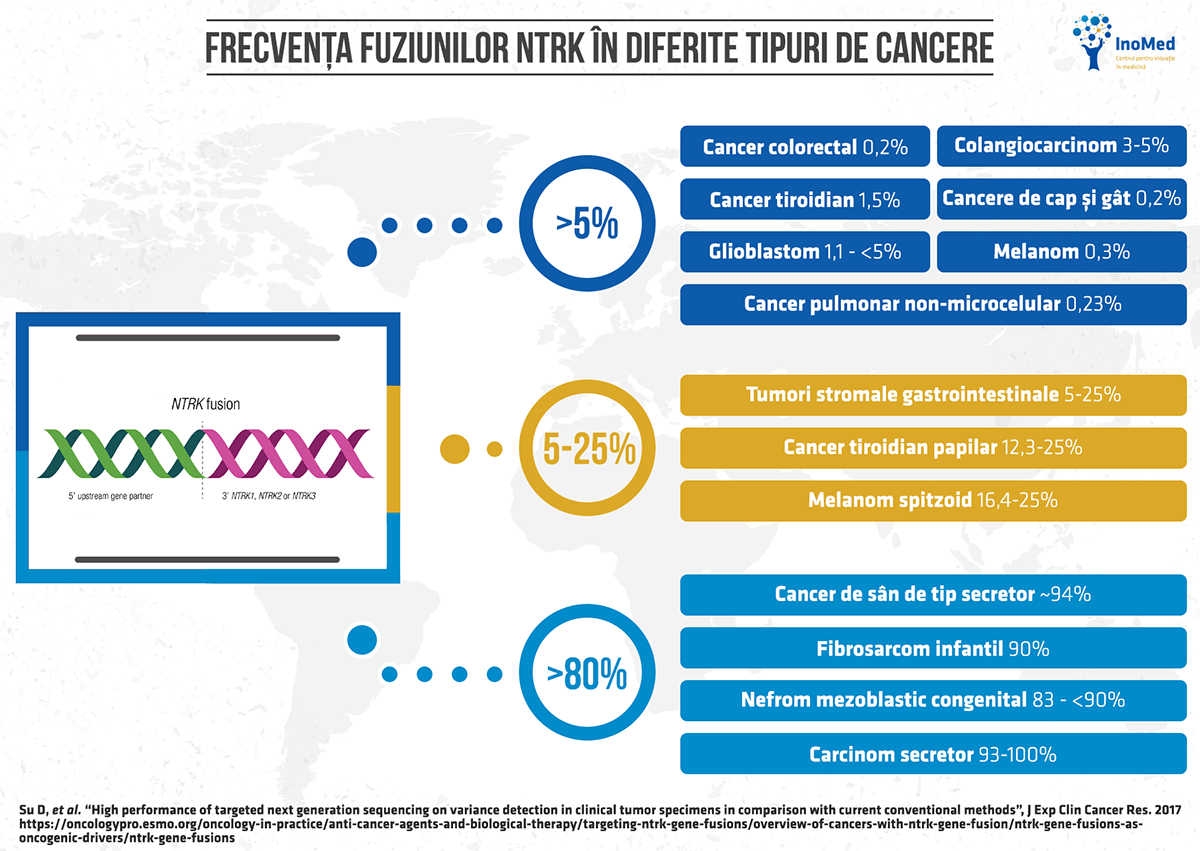
Acum 30 de ani au apărut primele indicii referitoare la rolul genelor NTRK în carcinogeneză. Fuziunile NTRK au fost descrise în tumori colorectale și tiroidiene inițial, iar ulterior au fost asociate și altor tipuri de cancere, inclusiv cancere pediatrice. Dintre toate categoriile de anomalii genetice, fuziunile sunt cele mai bine descrise, conducând la activarea oncogenei NTRK. Genele NTRK pot fuziona într-un mod haotic cu alte gene, ceea ce va determina o amplificare a semnalelor de creștere prin Trk care pot induce carcinogeneza. Sunt descrise până în prezent cel puțin 25 de fuziuni în care sunt implicate gene NTRK.
În cancerele rare, fuziunile NTRK apar cu frecvență înaltă, ca oncogene dominante; în timp ce în cancerele frecvente în populație, se identifică într-un număr foarte mic de cazuri.
Testarea NTRK ar permite extinderea numărului de pacienți care beneficiază de terapii țintite
Recent a fost publicat cel mai amplu studiu bazat pe date din viața reală care a evaluat prevalența fuziunilor NTRK. Studiul a inclus peste 295.000 de pacienți oncologici din baza de date FoundationCORE, care au urmat testare genomică comprehensivă. Prevalența fuziunilor NTRK a fost de 0,30% și s-au identificat 88 de parteneri de fuziune unici, care anterior nu au mai fost raportați. Prevalența cea mai mare a fost observată în cazul tumorilor de glande salivare (2,62%). Prevalența fuziunilor NTRK a scăzut cu vârsta, cea mai mare fiind înregistrată la copiii cu vârste de sub 5 ani (2,28%).
Prezența fuziunilor NTRK nu s-a corelat cu alți biomarkeri acționabili clinic, cu excepția cancerului colorectal. În cancerele colorectale cu fuziuni NTRK se observă și o asociere cu markerul MSI. Acestea sunt mutual exclusive cu prezența mutațiilor BRAF. Implicațiile clinice sunt importante deoarece testarea fuziunilor NTRK la pacienții cu cancer colorectal ale căror tumori sunt MSI-H pozitive și fără mutații BRAF ar putea extinde numărul pacienților eligibili pentru terapii țintite.
Secvențierea de nouă generație, recomandată de ghidurile ESMO ca metodă de primă linie pentru detectarea NTRK în practică, a permis identificarea unui număr mare de noi fuziuni în care e implicat NTRK. Studiul a demonstrat că proiectele ample de testare genomică comprehensivă facilitează identificarea de biomarkeri rari, care aduc informații esențiale pentru decizia clinică.
Inhibitorii NTRK aprobați internațional
În 2017, în Cadrul Întâlnirii Anuale a Societății Americane de Oncologie (ASCO), larotrectinib a demonstrat rezultat fără precedent în tumorile solide metastatice NTRK, la pacienții adulți și pediatrici. Larotrectinib este un inhibitor pan-TRK selectiv (TrkA, TrkB, TrkC), este considerat primul folosit într-adevăr într-o manieră „tumor-agnostic”, este prima terapie „tumor-agnostic” orală și prima terapie dezvoltată simultan pentru adulți și copii. Terapia a fost aprobată în 2018 în SUA și în 2019 în Uniunea Europeană.
Entrectinib este un inhibitor multikinazic, având ca ținte TrkA, TrkB, TrkC, ROS1 și ALK1. În 2019, Food and Drug Administration (FDA) a aprobat entrectinib printr-o procedură accelerată, pentru tumorile solide care prezintă fuziuni NTRK, la pacienții adulți și pediatrici. De asemenea, medicamentul a primit aprobare și pentru tratamentul cancerului pulmonar non-microcelular ROS1 pozitiv, la adulți. Acest moment marca a treia aprobare a unui tratament oncologic, indicat în funcție de prezența biomarkerilor moleculari și nu în funcție de localizarea tumorii. În 2020, entrectinib a primit aprobare în UE pentru tratamentul pacienților adulți și pediatrici cu vârste de peste 12 ani pentru tumorile solide care prezintă fuziuni NTRK și pentru adulții cu NSCLC ROS1 pozitiv.
Citește și:
- Carta Albă a biomarkerilor în cancerul pulmonar non-microcelular: importanța diagnosticului de precizie pentru cele mai bune rezultate terapeutice. Recomandări pentru România
- Congresul Național de Oncologie 2021: Dr. Marius Geantă, despre medicina personalizată și importanța implementării în România a testării biomarkerilor de tip tumor agnostic

