FDA aprobă atezolizumab ca primă linie de tratament în cancerul pulmonar non-microcelular metastazat cu expresie PD-L1 ridicată
Administrația Alimentelor și Medicamentelor SUA (FDA) a aprobat atezolizumab (denumire comercială Tecentriq, produs de Genentech Inc.), pentru a fi utilizat în monoterapie la pacienții diagnosticați cu cancer pulmonar non-microcelular (NSCLC) metastatic, în cazul tumorilor care prezintă o expresie ridicată a PD-L1. De asemenea, a fost aprobat testul diagnostic care însoțește tratamentul, pe baza căruia atezolizumab poate fi prescris (Ventana PD-L1 SP142 Assay, produs de Ventana Medical Systems, Inc.).
Atezolizumab poate fi prescris pacienților care prezintă markerul PD-L1 la suprafața a ≥ 50% dintre celulele tumorale, sau la suprafața celulelor imunitare, care au invadat ≥ 10% din volumul tumoral, și care nu prezintă mutații EGFR sau ALK în celulele tumorale. Doza recomandată este de 840 mg la 2 săptămâni, 1200 mg la 3 săptămâni, sau 1680 mg la 4 săptămâni, administrat intravenos lent, pe parcursul a 60 de minute.
Rezultatele atezolizumab în studii
Aprobarea FDA vine în urma rezultatelor pozitive demonstrate de atezolizumab în studiul IMpower110, un studiu de fază III, randomizat, open-label, care a inclus pacienți din mai multe țări. Cei 572 de participanți au fost diagnosticați cu cancer pulmonar stadiul IV, non-microcelular, scuamos sau alte histologii, cu expresie PD-L1 și nu aveau tratament chimioterapic în antecedente. Aceștia au primit, în mod aleatoriu, fie atezolizumab, fie chimioterapie cu compuși pe bază de platină (carboplatin sau cisplatin) și pemetrexed (tumorile cu histologie non-scuamoasă) sau gemcitabină (cancer cu celule scuamoase).
Supraviețuirea globală a fost semnificativ mai mare printre pacienții din grupul de studiu:
- Atezolizumab a condus la o supraviețuire globală mediană de 20,2 luni, față de 13,1 luni în cazul chimioterapiei;
- Eficiența a fost similară în cadrul grupului de studiu, indiferent de gradul de expresie a PD-L1;
- În medie, pacienții aflați sub tratament cu atezolizumab au supraviețuit 8,1 luni fără progresia bolii, și 5 luni în grupul de control;
- Rata de răspuns la tratament a fost de 38% în cazul atezolizumab și de 29% în cazul chimioterapiei.
În ceea ce privește profilul de siguranță, atezolizumab a fost bine tolerat, cea mai frecventă reacție adversă (≥ 20% dintre pacienții tratați) fiind astenia.
Despre atezolizumab
Atezolizumab este un anticorp monoclonal care se leagă de proteina PD-L1, exprimată pe celulele tumorale și pe celulele imune care pătrund în tumoră, blocând interacțiunile sale cu receptorii PD-1 și B7. Prin inhibarea PD-L1, Tecentriq favorizează activarea celulelor T. Este o imunoterapie care are potențialul de a fi utilizată în combinație cu alte imunoterapii, terapii țintite și diverse chimioterapii în managementul unei game largi de cancere. Dezvoltarea Tecentriq se bazează pe o mai bună înțelegere a modului în care sistemul imunitar interacționează cu tumorile și modul în care valorificarea sistemului imunitar al unei persoane combate mai eficient cancerul. Atezolizumab este aprobat în SUA, UE și țări din întreaga lume, fie singur, fie în combinație cu terapii țintite și/sau chimioterapii în diverse forme de cancer.
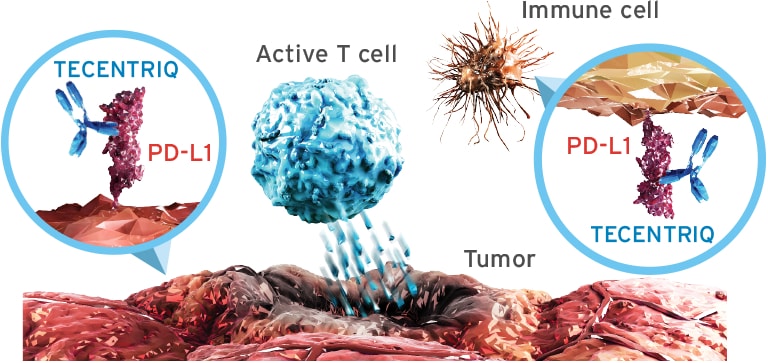
Sursa foto: Tecentriq.com
În Uniunea Europeană, EMA a aprobat atezolizumab în următoarele indicații:
- Cancerul urotelial avansat local sau metastatic;
- Ulterior chimioterapiei pe bază de compuși de platină;
- La pacienții cu contraindicație de compuși de platină, cu o expresie tumorală PD-L1 ≥ 5%;
- Cancerul pulmonar non-microcelular avansat local sau metastatic, în monoterapie, ulterior chimioterapiei (sau a terapiei țintite, la pacienții care prezintă mutații EGFR sau ALK);
- Cancerul mamar triplu negativ, nerezecabil, avansat local sau metastatic, cu expresie tumorală PD-L1 ≥ 1%, în combinație cu nab-paclitaxel.
În cazul acestei noi aprobări, atezolizumab a beneficiat de o serie de instrumente, dezvoltate de FDA cu scopul facilitării accesului pacienților la noile terapii (Assessment Aid și analiza prioritară a dosarului de aprobare), ceea ce a condus la o aprobare anunțată cu o lună mai devreme decât data-limită stabilită inițial.
Dezvoltarea de opțiuni terapeutice multiple are o importanță majoră în cancerul pulmonar, acesta fiind cel mai frecvent tip de cancer, responsabil de 1,69 milioane de decese la nivel mondial în anul 2015. Acesta este asociat cu factori de risc evitabili într-o proporție de 85.8%, cel mai important fiind fumatul, însă și fumatul pasiv, dieta inadecvată (consum insuficient de fructe și legume) și expunerea la anumite substanțe cancerigene din atmosferă.
Citește și:
- FDA aprobă nivolumab + ipilimumab ca primă linie de tratament în cancerul pulmonar non-microcelular metastazat cu expresie PD-L1≥1%
- Premiul Nobel pentru Medicină 2018: înțelegerea mecanismelor prin care sistemul imunitar luptă împotriva cancerului
- #AACR20. Combinația de atezolizumab, vemurafenib și cobimetinib crește supraviețuirea pe termen lung în melanomul avansat BRAF V600+

