FDA aprobă a treia terapie celulară CAR-T pentru limfomul cu celule B mari refractar sau recidivat
FDA a aprobat lisocabtagene maraleucel (liso-cel; Breyanzi), o terapie cu celule T anti-CD19, pentru tratamentul pacienților adulți cu limfom cu celule B mari, recidivat sau refractar la cel puțin două linii anterioare de terapie sistemică.
„Aprobarea de astăzi reprezintă o altă etapă importantă în domeniul evoluției rapide a terapiei genice, oferind o opțiune suplimentară de tratament pentru adulții cu anumite tipuri de cancer care afectează sângele, măduva osoasă și ganglionii limfatici”, a declarat Prof. Dr. Peter Marks, Director al Centrului pentru evaluarea și cercetarea terapiilor biologice din cadrul FDA.
Liso-cel a devenit astfel a treia terapie genică aprobată de FDA pentru tipuri specifice de limfom non-Hodgkin. Cu toate acestea, terapia CAR-T nu este indicată pentru tratamentul pacienților cu limfom primar al sistemului nervos central.
„Terapiile genetice și celulare au evoluat de la concepte promițătoare, la regimuri practice de tratament al cancerului”, a completat Prof. Dr. Peter Marks.
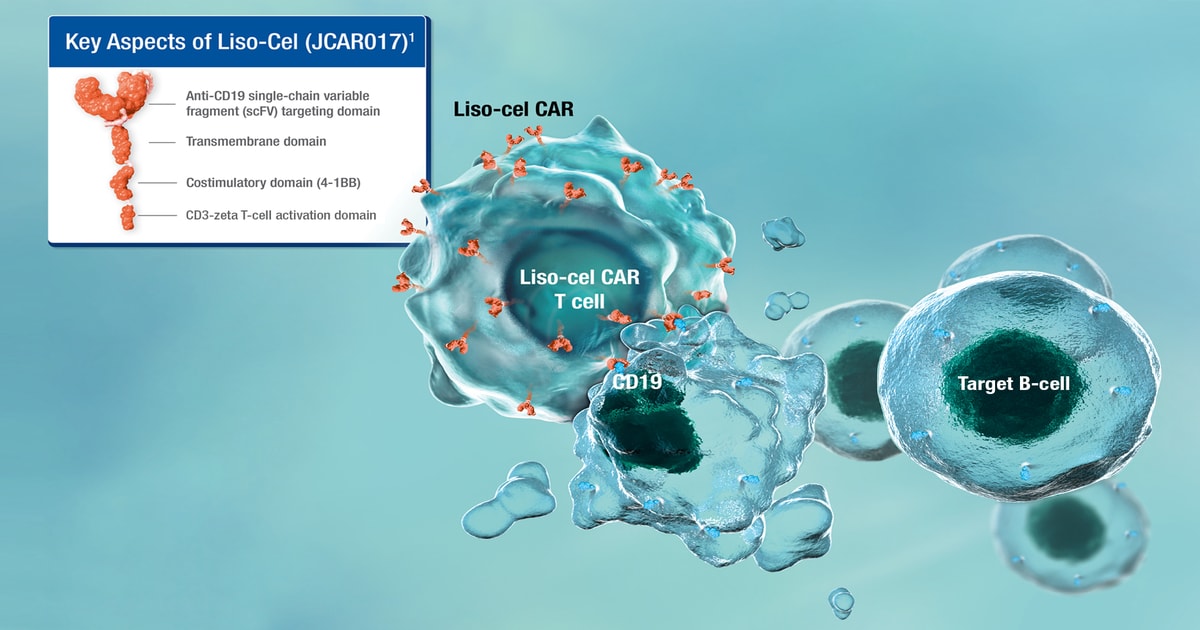
Siguranța și eficacitatea Liso-Cel
Aprobarea liso-cel se bazează pe constatările primare din studiul de fază I, TRANSCEND NHL 001, care și-a îndeplinit obiectivele primare și secundare. În total, 256 din 344 de pacienți, la care s-a realizat leucafereză, au putut fi evaluați în studiu pentru eficacitate. Studiul multicentric, deschis, non-randomizat, rămâne în curs de desfășurare.
Studiul a înrolat pacienți cu limfom cu celule B mari, tratat multiplu și agresiv, în medie cu trei terapii anterioare. 35% dintre pacienții înrolați au primit anterior transplant de celule stem hematopoietice autologe sau alogene, iar 67% dintre pacienți au avut boală refractară la chimioterapie.
Rata generală de răspuns a fost de 73%, care a inclus 186 de răspunsuri terapeutice complete. Mai mult de jumătate (53%) dintre pacienți au obținut un răspuns complet. Durata mediană a răspunsului nu a fost încă atinsă în populația generală, dar durata răspunsului la 6 luni a fost de 60% și la 12 luni a fost de 54,7%.
Supraviețuirea mediană fără progresia bolii a fost de 6,8 luni, ratele de supraviețuire fără progresie la 6 luni fiind de 51,4%, respectiv 44,1% la 12 luni. Supraviețuirea globală mediană a fost de 21,1 luni, iar rata totală de supraviețuire la 6 luni a fost de 74,7%, cu rata de supraviețuire la 12 luni de 57,9%.
Potrivit analizei de siguranță, 79% dintre pacienți au prezentat evenimente adverse de grad ≥ 3 după tratament, inclusiv neutropenie la 60% dintre pacienți, anemie la 37% și trombocitopenie la 27%.
În total, șapte pacienți au decedat în urma evenimentelor adverse emergente tratamentului, care include atât terapia CAR-T, cât și chimioterapia, iar cauzele au inclus: leziuni pulmonare alveolare difuze, hemoragie pulmonară, sindrom de disfuncție multiplă a organelor, cardiomiopatie.
Sindromul de eliberare a citokinelor a fost observat la 42% dintre pacienți, timpul mediu până la debut fiind de 5 zile. Sindromul de eliberare a citokinelor de grad ≥3 a apărut însă la numai 2% dintre pacienți. Evenimentele neurologice au fost prezente la 30% dintre pacienți. S-a observat o incidență mai mare a sindromului de eliberare a citokinelor și a evenimentelor neurologice la pacienții cu o încărcătură tumorală ridicată sau markeri inflamatori crescuți, precum și la cei care au primit o terapie de legătură (bridging therapy).
Neurotoxicitatea și sindromul de eliberare de citokine reprezintă efecte adverse asociate terapiei celulare CAR-T și au potențial fatal în lipsa unei monitorizări adecvate a tratamentului. Terapiile direcționate împotriva antigenului CD19, primele care au apărut, au fost și cele studiate pentru o perioadă mai lungă. S-au acumulat dovezi științifice care susțin faptul că balanța risc-beneficiu este favorabilă.
Administrarea terapiilor CAR-T trebuie să fie urmată de o monitorizare adecvată, care să respecte protocoalele terapeutice. Din cauza riscului de sindrom de eliberare a citokinelor și a toxicității neurologice, liso-cel a fost aprobat cu un program de evaluare și strategie de atenuare a riscurilor (REMS), iar FDA a cerut ca facilitățile medicale care administrează liso-cel să fie certificate în acest sens. Este necesar un studiu observațional după punerea pe piață pentru a evalua în continuare siguranța pe termen lung a terapiei CAR-T.
Liso-Cel, a treia terapie CAR-T aprobată pentru DLBCL
Limfomul difuz cu celule B mari (DLBCL) este o boală agresivă, rapid progresivă. Este cel mai frecvent tip de limfom non-Hodgkin și reprezintă unul din trei cazuri diagnosticate. Dintre acești pacienți, 73% nu răspund sau recidivează după tratamentul de linia a doua sau mai târziu. Pentru pacienții care recidivează sau nu răspund corespunzător la tratament, nu există multe opțiuni convenționale de tratament, iar speranța medie de viață este de aproximativ 6 luni.
Liso-Cel, terapia CAR-T direcționată contra CD19, oferă promisiunea unei abordări curative a limfomului. Terapia genică, celulară și imunoterapia CAR-T a reprezentat un punct de turnură în înțelegerea și tratarea cancerului, cu rezultate pozitive durabile în cazul unor pacienți care nu mai aveau alte opțiuni terapeutice. Cele două terapii aprobate în 2017 în SUA și în 2018 în UE, Kymriah și Yescarta, sunt deja utilizate în mai multe sisteme de sănătate din lume pentru tratamentul limfomului difuz cu celule B mari.
Aflați mai multe despre ce sunt și cum funcționează terapiile celulare CAR-T.
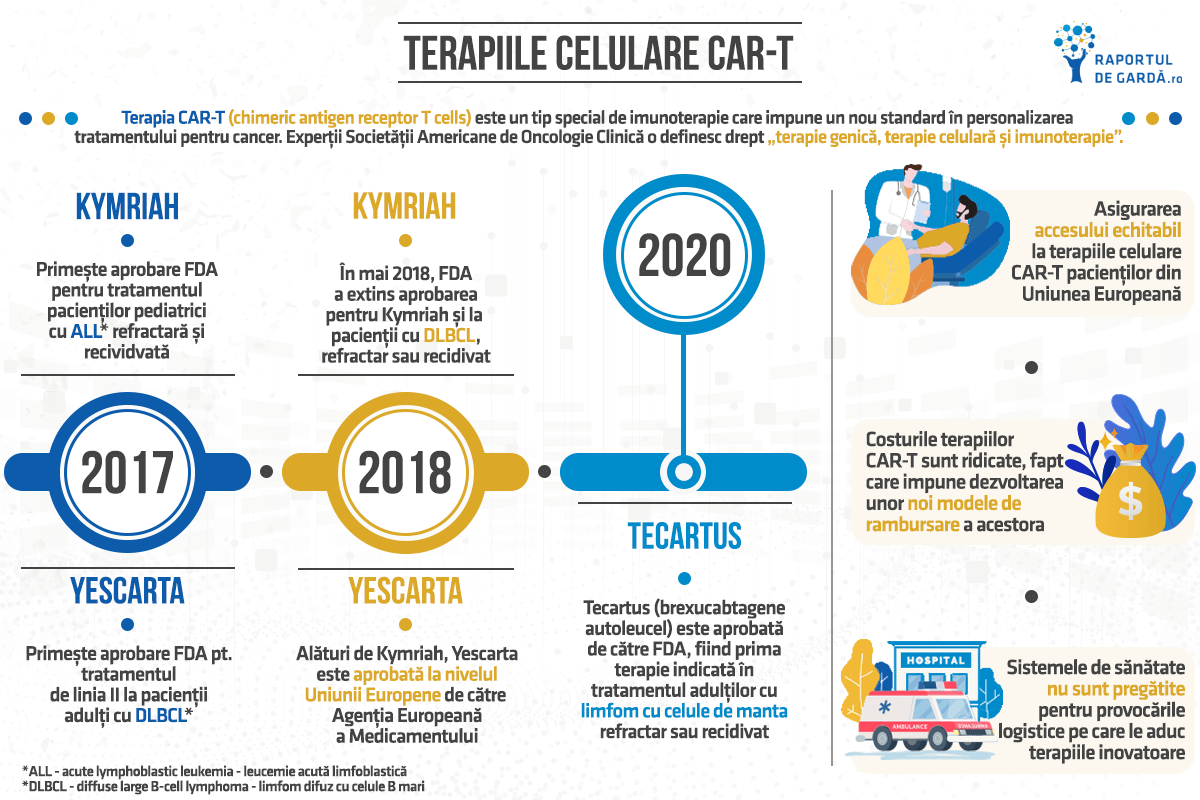
Există multiple provocări cu privire la accesul pacienților la aceste terapii – de la procesul complex de fabricație, până la rambursarea acestor tratamente inovatoare. România este unul dintre statele UE unde nu este încă posibilă administrarea terapiilor celulare CAR-T, însă demersurile în acest sens sunt în desfășurare.
Carta Albă a terapiilor celulare 2020 a fost lansată la sfârșitul anului în cadrul unui eveniment online – Terapiile celulare CAR-T în sistemul de sănătate din România – organizat de către Centrul pentru Inovație în Medicină și sponsorizat de compania farmaceutică Novartis.
Citește și:
- #EHA2020. Terapia CAR-T Liso-Cel induce o rată generală de răspuns de 89% în limfomul non-Hodgkin cu celule B recidivant sau refractar
- FDA aprobă prima terapie CAR-T pentru tratamentul limfomului cu celule de manta: brexucabtagene autoleucel
- Noile generații de terapii CAR-T: cele mai importante studii prezentate la ASH 2019

