FDA a aprobat durvalumab, prima imunoterapie pentru carcinomul pulmonar non-microcelular (NSCLC), în stadiul 3, nerezecabil
Pentru prima dată, Food and Drug Administration a aprobat o imunoterapie pentru cancerul pulmonar fără celule mici (NSCLC) în stadiul III, nerezecabil, la pacienții care nu au înregistrat o creștere tumorală după chimioterapie. Durvalumab (Imfinzi), un inhibitor PD-L1, a devenit primul tratament aprobat de FDA care reduce semnificativ riscul de progresie a bolii în acest stadiu. Până acum, celelalte imunoterapii au fost aprobate pentru stadiul IV, metastatic, al bolii.
Pacienții cu carcinom pulmonar fără celule mici local avansat, stadiu III cu tumori nerezecabile aveau până acum chimioradioterapia (CRT) drept unică variantă terapeutică.
„Aprobarea Imfinzi în acest stadiu mai timpuriu al bolii are o semnificație foarte mare pentru pacienții care până acum nu au avut nici un tratament disponibil după CRT. Global, 30% dintre pacienții cu NSCLC se află în stadiul 3 al bolii și suntem foarte entuziasmați să lansăm prima imunoterapie pentru această indicație” – Dave Frederickson, vicepreședintele Departamentului de Oncologie, AstraZeneca
Aprobarea se bazează pe rezultatele studiului PACIFIC și schimbă paradigma tratamentului cancerului pulmonar deoarece demonstrează, în premieră, că o imunoterapie are beneficii într-un stadiu mai puțin avansat al bolii. În toate studiile privind imunoterapiile pentru cancerul pulmonar de până de până acum indicația a fost cancer avansat sau metastatic.
Principalele rezultate din studiul PACIFIC:
- durvalumab crește supraviețuirea fără progresie a bolii cu 11,2 luni comparativ cu placebo
- 72,8% dintre pacienți au avut un răspuns susținut și la 12 și la 18 luni
- doar 16,5% dintre pacienții care au primit durvalumab au înregistrat o progresie a bolii, prin comparație cu 27,7% în grupul placebo
„Pentru pacienții cu carcinom pulmonar non-microcelular în stadiul III care nu poate fi îndepărtat chirurgical, abordarea terapeutică actuală pentru a preveni progresia este chimioradioterapia. Numai că un număr mic de pacienți au beneficii de pe urma acestei terapii, iar cancerul va continua să progreseze. Bolnavii au acum o terapie aprobată care s-a dovedit că împiedică progresia cancerului pentru mai mult timp după chimioradioterapie” – Richard Pazdur, director la Office of Hematology and Oncology Products din cadrul FDA
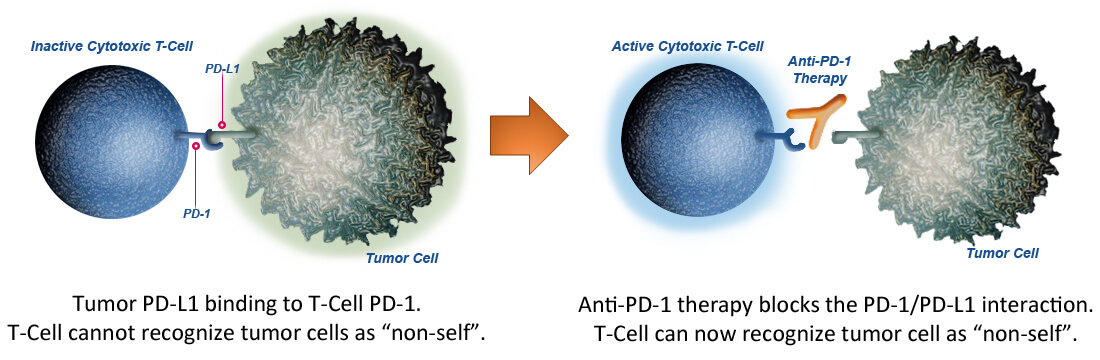
Durvalumab este un anticorp monoclonal umanizat, anti PD-L1 (checkpoint inhibitor). PD-L1 reprezintă o proteină care are o expresie crescută la nivelul celulelor tumorale și la nivelul infiltratului inflamator tumoral (celule dendritice sau macrofage). Aceasta se leagă de receptorul său de pe limfocitele T, PD-1 și inhibă proliferarea limfocitară și producerea de citokine. Blocând PD-L1, medicamentul crește capacitatea sistemului imun de a distruge celulele canceroase.
Studiul PACIFIC, derulat în 235 de centre din 26 de țări a stat la baza aprobării. 473 de pacienți au primit durvalumab și 236 placebo. Vârsta medie a pacienților a fost 64 de ani și majoritatea (91%) erau fumători. 70% dintre aceștia erau bărbați și 45,7% aveau carcinom de tip scuamos.
Obiectivele primare au fost supraviețuirea fără progesie a bolii (PFS) și rata de supraviețuire generală (OS – Overall Survival). Chimioradioterapia a fost utilizată cu rezultate similare între cele două grupuri. 25,8% din grupul cu durvalumab și 28,7 % grupul pacebo au primit CRT de inducție inainte de CRT standard.
Supraviețuirea fără progresie a bolii a fost de 16,8 luni pentru durvalumab comparativ cu 5,6 luni în cazul placebo. Rata de supraviețuire la 18 luni a fost de 44,2% la pacienții tratați cu durvalumab și de 27% pentru placebo. Datele referitoare la supraviețuirea generală (OS) sunt încă dificil de estimat și nu au fost încă analizate.
Dintre pacienții care au avut beneficii de pe urma terapiei cu durvalumab, 72,8% au avut un răspuns susținut la 12 și la 18 luni comparativ cu 56,1% și 46,8% în grupul placebo.
Doar 16,5% dintre pacienții care au primit durvalumab au înregistrat o progresie a bolii prin comparație cu 27,7% în grupul placebo. Reacțiile adeverse imune de grad 3/4 au fost mai mari în grupul cu durvalumab (3,4% comparativ cu 2,6%). Pneumonia a fost cea mai frecventă reacție adeversă la pacienții care au primit durvalumab.
Durvalumab, produs de AstraZeneca, mai are o aprobare FDA pentru cancerul de vezică urinară local avansat sau metastatic. Medicamentul s-a alăturat altor 2 imunoterapii (nivolumab și atezolizumab) pentru tratamentul cancerelor uroteliale, în mai 2017.
Articole similare
- Pembrolizumab, mai aproape de pacienții români: ANM aprobă includerea condiționată pe lista de compensare pentru tratamentul de linia I și linia II al cancerului pulmonar avansat
- Pembrolizumab crește supraviețuirea generală de peste două ori mai mult decât chimioterapia la pacienții cu carcinom pulmonar non-microcelular avansat, PD-L1 pozitiv
- #ESMO17: Pembrolizumab scade cu 19% riscul de deces în cazul pacienților cu carcinom scuamos de cap și gât, recurent sau metastatic
- #ESMO17: STUDIU. Pembrolizumab: eficacitate pentru cancerul gastric metastazat, linia a doua de tratament

