PREMIERĂ. Secvențierea întregului genom, validată ca test de primă linie pentru diagnosticul bolilor rare în UK. Care sunt beneficiile pentru pacienți și pentru sistemul de sănătate?
Peste 80% dintre bolile rare au o componentă genetică, iar 70% dintre acestea au debut în copilărie. Introducerea secvențierii genomice a crescut rata de diagnostic pentru bolile rare în ultimul deceniu, însă aceasta nu este folosită de rutină în practica medicală. Abordarea clasică la nivelul sistemelor de sănătate pentru diagnosticul bolilor rare implică realizarea de teste țintite, conducând la întârzieri majore în obținerea rezultatelor. Se estimează că timpul până la diagnostic pentru pacienții cu boli rare poate să ajungă și până la 8 ani.
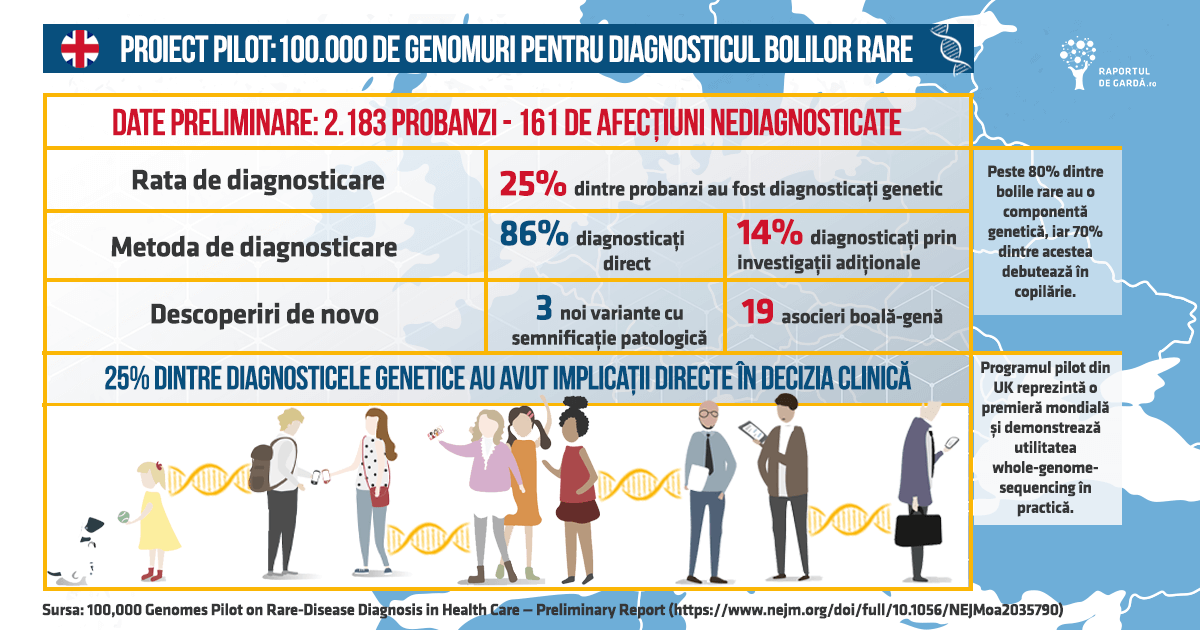
Un studiu în premieră la nivel mondial, publicat în New England Journal of Medicine, demonstrează fezabilitatea introducerii în practica medicală a secvențierii întregului genom (WGS – whole genome sequencing), care poate crește semnificativ rata de diagnosticare a bolilor rare. Studiul pilot a inclus peste 4.000 de persoane din Proiectul 100.000 de Genomuri (100.000 Genomes Project) și a arătat că pentru 25% dintre participanți, rezultatul WGS a avut un impact clinic direct, atât asupra pacientului, cât și asupra familiei acestuia. 14% dintre cazuri prezentau mutații la nivelul unor regiuni din genom care nu ar fi fost detectate prin metodele standard (în regiuni necodante, în ADN-ul mitocondrial). Studiul este realizat de Genomics England și Universitatea Queen Mary din Londra împreună cu National Institute for Health Research (NIHR) .
Aceasta este prima dovadă solidă asupra valorii pe care secvențierea întregului genom o aduce în sistemului de sănătate și poate reprezenta un model de bune practici și pentru alte țări. Un diagnostic confirmat la nivel genomic oferă acces la informații asupra prognosticului, tratamentului, opțiunilor legate de reproducere și poate reduce costurile în sistemul medical.
În Regatul Unit, programul pilot reprezintă baza științifică pentru dezvoltarea NHS National Genomic Test Directory, prin care sunt clasificate bolile pentru care se va realiza secvențierea genomică drept test de primă linie. NHS England va secvenția, în următorii 5 ani, 500.000 de genomuri de la pacienții cu cancere și boli rare, în cadrul noului program National Genomic Medicine Service.
Rezultatele studiului arată impactul WGS asupra traseului pacienților cu boli rare, dar și asupra resurselor NHS. S-au obținut 4 diagnostice care au condus la schimbarea medicației, 26 care au condus la monitorizarea membrilor familiilor probandului (prima persoana diagnosticată cu o boală genetică din familie), 13 care au permis includerea într-un studiu clinic, 59 au informat deciziile privitoare la reproducere și 32 cu alte tipuri de informații acționabile.
Două cazuri din acest studiu pilot pot ilustra impactul la nivel individual, la nivelul familiilor, dar și al sistemului de sănătate:
- O fetiță de 10 ani a fost internată în secția de terapie intensivă pentru o formă severă de varicelă. Pacienta suferea de o imunodeficiență primară (printr-o anomalie la nivelul genei CTPS1) pentru care stabilirea unui diagnostic a necesitat mai mult de 7 ani, cu un istoric de cel puțin 300 de internări în spital și multiple internări în secțiile ATI. Costurile asociate internării au fost de aproximativ 350.000 lire sterline. Diagnosticul genomic a indicat nevoia unui transplat de măduvă osoasă (£70,000), iar testarea predictivă a membrilor familiei arată că nu există alte persoane la risc.
- Un bărbat de 60 de ani a urmat tratamente diverse pentru o boală severă de rinichi de-a lungul timpului și a ajuns în final la transplant renal. În urma testării prin WGS s-a diagnosticat o boală genetică (o mutație la nivelul genei INF2 care a cauzat glomeruloscleroză focală segmentară), moștenită și de fiica sa, iar nepoata de 15 ani era sub supraveghere medicală. În urma testării, s-a descoperit că nepoata nu era la risc și a putut renunța la controalele regulate care impuneau costuri semnificative.
În 2013, guvernul Regatului Unit a lansat inițiativa 100.000 Genomes Project, prin care s-a realizat secvențierea întregului genom pentru pacienți cu cancere, boli infecțioase și boli rare din sistemul NHS. Proiectul are ca scop transformarea sistemului de sănătate prin facilitarea accesului la tehnologii avansate de diagnostic și asigurarea accesului la terapii personalizate. Până în prezent s-au identificat mutații acționabile pentru 1 din 4 pacienți cu boli rare și 50% dintre cazurile de cancere sunt candidate pentru o terapie sau un studiu clinic.
100,000 Genomes Pilot on Rare-Disease Diagnosis in Health Care
Studiul pilot a inclus 4.660 de participanți din 2.183 familii, cazurile fiind selectate din 9 spitale din Regatul Unit. Participanții erau eligibili dacă aveau suspiciune de boală rară (care afectează ≤1 din 2000 persoane, conform definiției din UK), dar fără un diagnostic confirmat genomic. În cadrul 100.000 Genomes Project participanții sunt urmăriți pe tot parcursul vieții prin registrele electronice (toate spitalizările, intrarea în registru, cauzele de deces, etc).
Un sistem automatizat a fost dezvoltat pentru prioritizarea variantelor și interpretarea datelor genomice pentru NHS Genomic Medicine Centres, astfel încât fiecare pacient să primească un raport corect. Au fost analizate regiunile codante și necodante de la nivelul genomului pentru detectarea de noi variante relevante pentru diagnostic, sugestive pentru fenotipul pacientului.
Rezultatele preliminare arată o creștere semnificativă a ratei de diagnosticare prin WGS, fiind identificat un spectru important de boli rare. Beneficiile s-au observat indiferent dacă participanții au urmat alte tipuri de teste genetice țintite anterior.
- Pentru 25% dintre cei cu un diagnostic stabilit pe baza WGS s-au obținut informații relevante clinic, ce puteau informa interveniții medicale imediate;
- S-a obținut o eficacitate mai mare a diagnosticului pentru bolile considerate a avea o cauză monogenică versus cele considerate complexe, poligenice (35% versus 11%). Cele mai frecvente au fost bolile oftalmologice, metabolice și neurologice;
- 14% dintre mutații au fost identificate în regiuni ale genomului care nu ar s-au putea analiza prin metode convenționale (ADN mitocondrial, regiuni necodante).
Până acum, obținerea rambursării secvențierii întregului genom a fost considerată o provocare la nivelul sistemului de sănătate. Acest tip de testare conduce la obținerea multor variante cu semnificație incertă, a căror interpretare poate fi dificilă. De aceea, se preferă panelurile țintite sau doar secvențierea exomului (regiunea din genom care codifică proteine).
Acesta este primul proiect reprezentativ la nivel internațional care arată avantajele diagnosticării în practica clinică pe baza WGS și pune bazele pentru implementarea acestui tip de testare în sistemele de sănătate. Pentru pacienții cu anumit afecțiuni neuropsihiatrice (ex. dizabilitate intelectuală), metabolice deja secvențierea genomică este considerată test de primă linie în serviciile NHS.
Studiul aduce în prim plan și importanța colectării datelor de la pacienții cu boli rare. Integrarea diferitelor tipuri de date, alături de noile dezvoltări tehnologice vor conduce la progrese în stabilirea diagnosticului și dezvoltarea de noi terapii. Una dintre provocările principale va fi extinderea aplicațiile WGS pentru screening, care ar facilita identificarea bolilor rare la persoane pre-simptomatice.
În urma unei intense consultări publice, în septembrie 2021, Genomics England, a anunțat că va lansa și un proiect pilot de secvențierea genomului de la 200.000 de nou-născuți – adică o treime din copiii născuți anual în UK. Prin Newborn Genomics Programme 1 din 3 nou-născuți ar putea beneficia de secvențierea completă a genomului. Datele vor fi analizate pentru depistarea anumitor afecțiuni rare specifice copilăriei, care pot beneficia de una dintre terapiile genice deja aflată pe piață sau în curs de dezvoltare. Pe termen lung există posibilitatea ca datele să fie stocate și utilizate mai târziu în viață pentru personalizarea îngrijirii medicale sau pentru determinarea riscului de a dezvolta boli comune, cum este cancerul.
Citește și:
- State of Innovation 2021. Medicina genomică: secvențierea completă a genomului uman. Cum se va schimba practica medicală în următorii ani?
- STUDIU. Prin testare comprehensivă genomică pot fi identificate mutații acționabile la 80% din pacienții cu cancere avansate
- INTERVIU. Dorica Dan, despre accesul la servicii medicale și inovație pentru pacienții cu boli rare în contextul COVID-19

