Genomics England va lansa un program pilot pentru secvențierea întregului genom (WGS) de la 200 de mii de nou-născuți. Câte boli rare ar putea fi depistate și tratate astfel?
Analiza genomică la scară largă și-a demonstrat valoarea și a venit în atenția publică mai mult ca oricând de la Human Genome Project în 2001, în contextul COVID-19. Primul genom SARS-CoV-2 a fost secvențiat în doar 34 de zile, iar după 6 luni, zeci de mii de genomuri erau deja disponibile în bazele de date globale. Odată cu creșterea capacității de secvențiere, costurile au scăzut, fiind eficientizat timpul de realizare. Noua infrastructură ar putea fi utilizată și după pandemie. Genomul uman poate fi secvențiat cu un cost de aproximativ 100$, în mai puțin de 24 de ore. Obiectivul „genomics for all” poate deveni o realitate.
Marea Britanie s-a remarcat deja ca lider global în secvențierea SARS-CoV-2. Rapiditatea s-a datorat faptului că exista o vastă experiență anterioară – 100.000 Genomes Project este doar un exemplu. Genomics England, o companie de stat din subordinea NHS (National Health Service) UK, va lansa un proiect pilot de secvențierea genomului de la 200.000 de nou-născuți – adică o treime din copiii născuți anual în UK.
„Capacitatea de a secvenția și analiza întregul cod genetic al unei persoane are potențialul de a crea o schimbare fără precedent în modul în care funcționează NHS, trecând la un sistem de sănătate mai axat pe prevenție”, motiva Genomics England demersul într-un comunicat de presă.
„Cinci până la 7% dintre oameni se nasc cu o boală rară și mulți ar putea fi tratați în primele zile de viață dacă se detectează boala. Secvențierea genomului ar putea ajuta. Costurile au scăzut atât de mult, încât suntem acum într-un punct în care este o greșeală dacă nu o facem”, a declarat Richard Scott, Directorul Medical al Genomics England, într-un editorial al revistei Science.
Recent, programul sloven dedicat screeningului nou-născuților a fost identificat ca model de bune practici de către CE. În contextul Președinției Sloveniei la Consiliul UE 2021, pe 11 octombrie 2021 a fost organizată o întâlnire dedicată echității și inovării în screeningul pediatric pentru hipercolesterolemie familială în întreaga Europă. Pagina oficială, aici

Inițial, datele genomice vor fi analizate pentru depistarea anumitor afecțiuni genetice rare specifice copilăriei, care pot beneficia de una dintre terapiile genice deja aflată pe piață sau în curs de dezvoltare. Însă există posibilitatea ca datele să fie stocate și utilizate mai târziu în viață pentru personalizarea îngrijirii medicale sau pentru determinarea riscului de a dezvolta boli comune, cum este cancerul. Această utilizare secundară a datelor este aliniată cu opinia publică obținută în urma consultării cu 130 de reprezentanți ai societății din Marea Britanie. În iunie 2021, Genomics England deschidea dialogul public cu privire la acest program, iar în iulie avea rezultatele:
- Ar fi acceptabil să se identifice un set mai larg de condiții decât programul actual de screening pentru nou-născuți (UK are deja un program de screening genetic în vigoare), dacă acestea au un impact asupra copilului în primele etape ale vieții și există tratamente și intervenții pentru vindecarea, prevenirea, încetinirea progresiei sau tratamente personalizate;
- Consilierea genetică și consilierea psihologică trebuie să fie disponibile pentru cei care primesc un diagnostic în urma secvențierii;
- Ar trebui stabilită o bază de date genetice comprehensivă, astfel încât persoanele din anumite medii să nu fie dezavantajate prin primirea unor diagnostice mai incerte sau mai puțin precise decât restul populației.
- Complexitatea WGS trebuie recunoscută în cadrul proceselor de consimțământ.
- Specificarea clară că testarea actuală are potențialul de a căuta și identifica mult mai multe afecțiuni decât testele de screening curente pentru nou-născuți.
- Dacă se solicită consimțământul pentru ca datele genomice să fie utilizate pentru cercetare, datele trebuie să fie anonimizate și utilizate pentru a oferi diagnostice, tratament și îngrijire mai bune.
Dorința de a citi genomul unui nou-născut datează din 2001, de la publicarea primei versiuni a genomului uman. Francis Collins, pe atunci director al Institutului Național de Cercetare a Genomului Uman, a prezis că va fi „fezabil” în termen de 20 de ani.
Urmăriți una dintre sesiunile speciale din cadrul Conferinței de Medicină Personalizată din 2020, în care cu expertul în domeniul genomicii, Dr. Eric Green, directorul Institutului Național de Cercetarea Genomului Uman din SUA a vorbit despre progresele în domeniul genomicii din ultimii 20 de ani:

Nivelul de detaliu obținut prin WGS poate face diferența între dizabilitate pe viață și lipsa ei
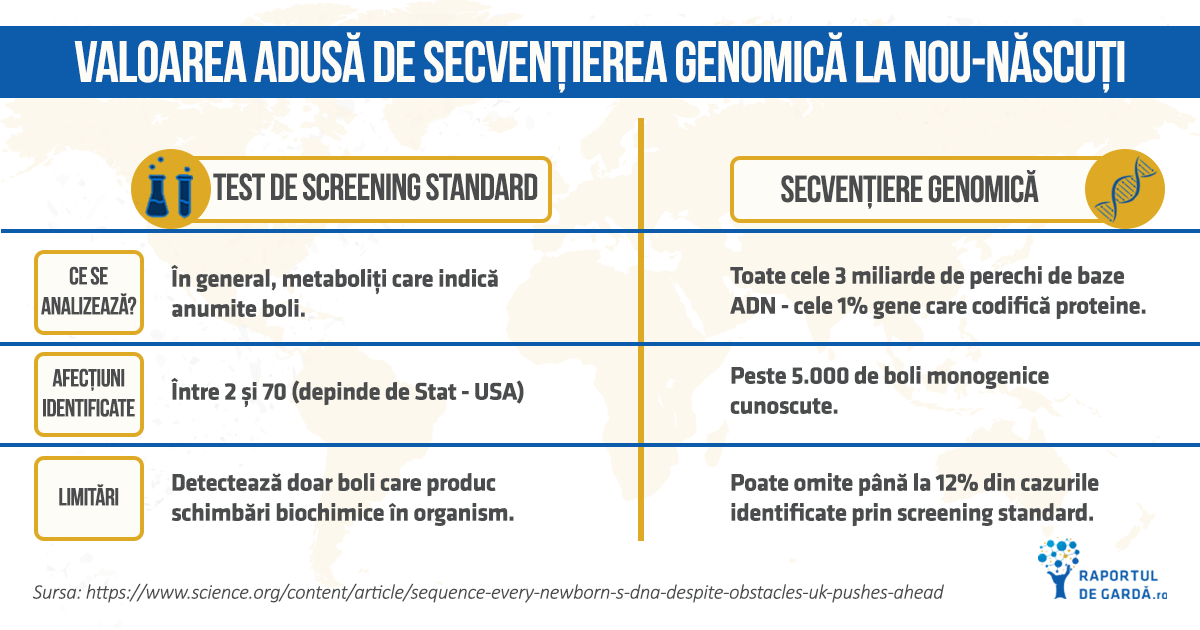
În 2016, se năștea în Boston, Cora, o fetiță care în momentul actual duce o viață normală și este un exemplu viu pentru valoarea adusă de WGS timpurie în viața oamenilor. În termen de 48 de ore de la naștere, personalul spitalului i-a recoltat din călcâi o picătură de sânge pentru a căuta molecule care semnalează zeci de boli genetice rare – un test standard pentru toți nou-născuții din SUA. Deoarece părinții Corei au fost de acord să o înscrie într-un studiu (BabySeq Pilot Study), sângele a fost utilizat și pentru un test mult mai larg – unul care a căutat în genom pentru aproximativ 1500 de gene cu implicații patologice.
Informațiile genetice s-au dovedit cruciale. Deși testul standard a semnalizat o tulburare care implică o enzimă de procesare a vitaminei B numită biotinidază, testul secundar de validare a ieșit negativ, iar medicul pediatru a concluzionat că mica nou-născută nu are această tulburare. Însă testul genomic a dezvăluit că are într-adevăr mutații care cauzează deficiența de biotinidază – o formă ușoară care, cu toate acestea, ar putea duce la „vedere proastă și dificultăți la școală”, conform părinților. Cora ia acum o tabletă zilnică de biotină și este un copil care se dezvoltă normal.
Totuși, conform specialiștilor, există și limitări ale utilizării exclusive a testării genomice: pot fi identificate mutații care nu vor afecta niciodată sănătatea copilului sau adultului, considerând că factorii ambientali sau alte procese nu vor interveni. Dintre cei 10 bebeluși sănătoși, dar cu gene de boală, numai în cazul Corei, rezultatele testelor clinice au indicat că este nevoie de tratament. De aceea, o abordare în care cele două tehnici sunt utilizate în același timp ar putea fi mai potrivită. Chiar dacă rezultatele nu indică nevoia de intervenție imediată, stocarea lor într-o bancă de date genomice ar putea fi utilă pentru îngrijiri medicale mai târziu în viață.
Situația României
Conform unor studii recente (2021) publicate în revista Frontiers in Pediatrics, respectiv International Journal of Neonatal Screening, care au analizat programele de screening din țările Europei de Sud-Est, în România (cel puțin la nivelul capitalei), prin Programele Naționale de Sănătate se efectuează la nou-născuți screeningul pentru două afecțiuni metabolice: hipotiroidism congenital și fenilcetonurie (PKU), pentru surditate și cea pentru depistarea retinopatiei prematurului. Mai mult, conform studiilor și unor raportări naționale, aceleași afecțiuni erau testate de rutină și acum 10 ani.
Citește și:
- State of Innovation 2021. Medicina genomică: secvențierea completă a genomului uman. Cum se va schimba practica medicală în următorii ani?
- Carta Albă a Terapiilor Genice: recomandări pentru implementarea în sistemul de sănătate din România
- Prioritățile programului EU4Health 2022: prevenția și promovarea sănătății

