State of Innovation 2021. Inovațiile care au făcut diferența în pandemia Covid-19: științele omice
Centrul pentru Inovație în Medicină publică anual raportul „State of Innovation” – un rezumat al celor mai importante inovații ale anului la nivel internațional, inovații care au făcut diferența în materie de sănătate sau care se află în faza de concept / dezvoltare și au potențialul de a schimba practica medicală și înțelegerea organismului uman. Anual, în ultima săptămână a lunii septembrie, europenii celebrează avansurile biotehnologice – European Biotech Week. În 2021, Raportuldegardă.ro și Centrul pentru Inovație în Medicină vor marca Săptămâna Europeană a Biotehnologiei printr-o serie de materiale desprinse din State of Innovation 2021, care va fi lansat oficial la finalul săptămânii în curs. În acest articol, discutăm despre prima temă: inovațiile care au făcut diferența în lupta cu pandemia Covid-19.
OMS lansa în 2018 un apel pentru cercetare și dezvoltare cu scopul de a pregăti lumea pentru boala X. Predicția s-a adeverit chiar la începutul anului 2020, când primele cazuri de pneumonie atipică detectate în China au dat semnalul de alarmă. Progresul științific a fost la fel de rapid ca răspândirea SARS-CoV-2. O copie virtuală a genomului era deja în Europa și în Statele Unite înainte ca virusul să ajungă acolo fizic. Chiar înainte de declararea pandemiei, boala X avea un nume, o cauză, un concept de vaccin, un test de diagnostic și mijloacele pentru ca întreaga comunitate științifică să comunice în timp real. Deși ne aflăm în cel mai bun moment din istorie pentru combaterea unei pandemii, SARS-CoV-2 este, mai mult ca niciodată, o țintă în mișcare. Inevitabil, multe dintre tehnologiile care s-au dezvoltat în ritm accelerat în cursul ultimului an vor fi indispensabile în continuare pentru controlul crizei COVID-19 și prevenirea următoarei boli X.
Tehnologiile omice și științele structurale au oferit răspunsurile la întrebări esențiale despre SARS-CoV-2 și despre patologia COVID-19 – au fost obținute hărțile de înaltă rezoluție ale genomului, transcriptomului, epitranscriptomului, proteomului sau interactomului viral, în timp record. Primul genom SARS-CoV-2 a fost secvențiat în doar 34 de zile, iar după 6 luni, zeci de mii de genomuri erau deja disponibile în bazele de date globale. Prin comparație, primul genom SARS-CoV-1 a fost publicat la 6 luni după debutul epidemiei SARS. Aplicațiile genomicii nu au fost niciodată mai relevante.
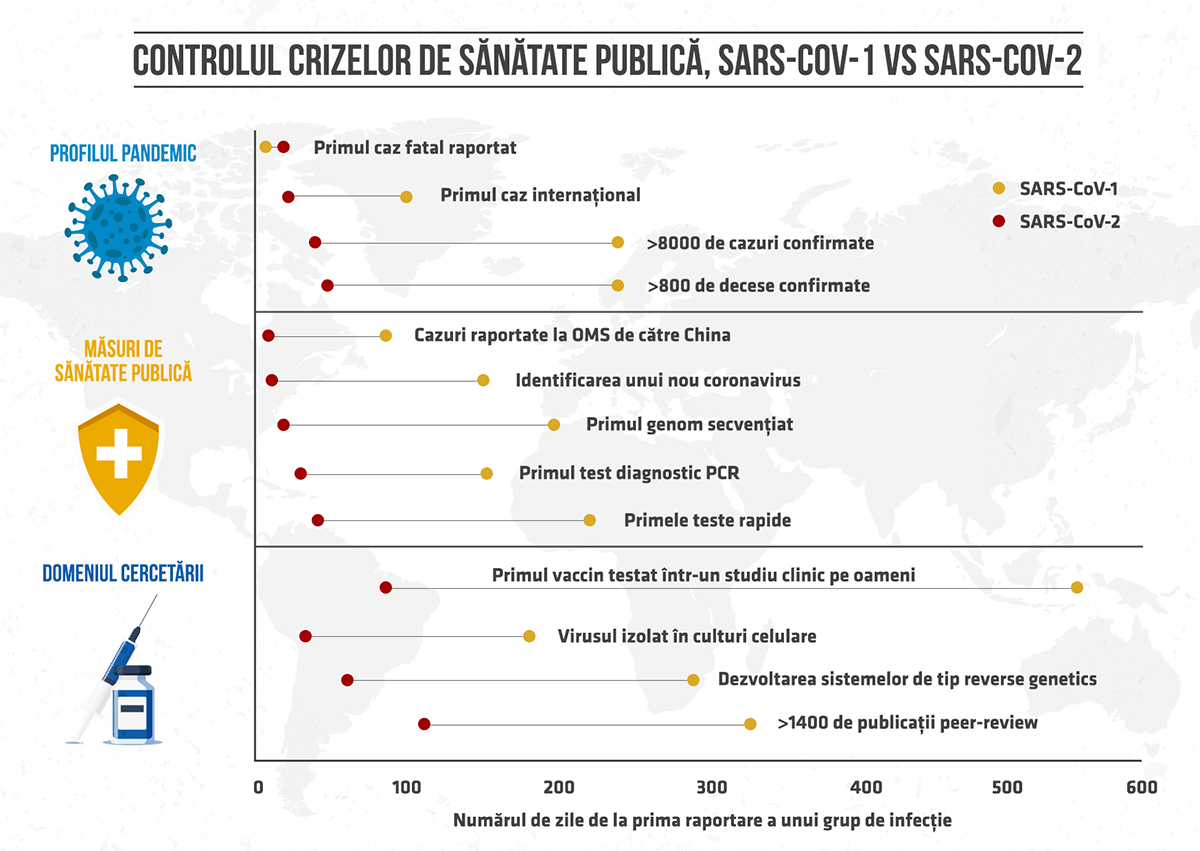
Un test PCR specific pentru SARS-CoV-2 a fost realizat în 13 zile de la publicarea primului genom, iar primele design-uri de teste erau propuse chiar înainte de publicarea acestuia, pe baza experienței cu epidemiile SARS și MERS. În mai 2020 era autorizat primul test de diagnostic bazat pe tehnologia de editare genomică CRISPR. O lună mai târziu era autorizat și primul test de diagnostic prin NGS, care returnează rezultatele în 24 de ore.
Costurile secvențierii masive paralele au scăzut semnificativ, la fel și timpul până la obținerea rezultatelor. Tehnologiile care permit secvențierea de mare capacitate (high throughput sequencing, deep sequencing), de generația a doua sau a treia au permis caracterizarea rapidă și comprehensivă a genomului, transcriptomului și epitranscriptomului viral. Dincolo de aplicații de cercetare, acestea sunt deja folosite de rutină în anumite țări pentru ghidarea măsurilor de sănătate publică, cel mai bun exemplu fiind liderul mondial în secvențierea la scară largă a SARS-CoV-2, COG-UK.
Secvențierea de generația III de tip nanopore a fost decisivă pentru creșterea accesibilității la analiza genomică și transcriptomică. Pe lângă diagnostic, utilizarea genomicii în epidemiologie a condus la instrumente care pot fi folosite în timp real și nu restrospectiv.
Proteomica oferă date esențiale pornind de la o singură proteină virală până la alcătuirea întregului virion sau chiar înțelegerea proteomului gazdei în timpul infecției. În loc de țintirea proteinelor virale, o strategie explorată în studii este maparea proteinelor umane cu care interacționează noul coronavirus.
Studiul interactomului a condus la identificarea de noi posibile ținte terapeutice, chiar dintre medicamentele deja aprobate. De exemplu, un tratament pentru cancer, plitidepsina (care inhibă translația proteinelor în celulă) s-a dovedit de aproape 30 de ori mai eficientă decât remdesivirul.
Chiar dacă secvența de aminoacizi dintr-o proteină poate fi simplu determinată din secvența de nucleotide, înțelegerea conformației proteinei necesită aportul biologiei structurale. Primele studii genetice și bazate pe modele digitale ale proteinei spike erau realizate în ianuarie 2020 și au condus la identificarea receptorului ACE2 ca punct de intrare în celulele umane. La începutul lunii februarie 2020, înainte ca lumea să realizeze iminența declarării unei pandemii, era clară secvența și forma proteinei Spike. Universitatea Texas și NIH au publicat o hartă 3D la rezoluție atomică a proteinei spike prin aportul noilor tipuri de microscopie electronică (cryo-electron microscopy). Apoi a urmat structura unei enzime virale (proteaza) descifrată cu ajutorul cristalografiei cu raze X. Prin comparație, prima structură a SARS-CoV-1 a fost obținută în 2005, la 2 ani de la epidemia SARS, iar descifrarea proteazei HIV a necesitat 4 ani.
Informațiile structurale au fost esențiale pentru că s-a observat că SARS-CoV-2 se leagă de 10-20 de ori mai ușor de ACE2 decât SARS-CoV-1. Astfel de date sunt utile pentru modelarea in silico a interacțiunii dintre proteine și pentru screeningul computerizat de mare capacitate a unor compuși cu proprietăți antivirale pentru descoperirea de terapii. În prezent, pe măsură ce noi variante virale sunt raportate, cunoașterea conformației proteinei spike și a modului în care acumulează mutații este mai importantă ca niciodată.
„Digitizing the virus”
Accesul la probe virale pentru diferite aplicații, în țări fără cazuri active, pune probleme în fazele inițiale ale unei pandemii. Astăzi a devenit posibilă asamblarea unui întreg genom viral de la zero fără să fie nevoie de o probă fizică. Simpla cunoaștere a genomului este suficientă. Tehnologia ADN-ului sintetic permite reconstrucția de genomuri virale în vectori artificiali. Astfel pot fi obținute fragmente ARN viabile și structuri virale care se pot replica. Prima cultură virală SARS-CoV-2 era pregătită într-o săptămână de la obținerea genomului sintetic. Folosirea ingineriei genetice pentru studierea relației genotip-fenotip și funcția componentelor virale permite validarea de teste diagnostice în absența probelor fizice; reverse genetic systems este un domeniu care capătă amploare.

O nouă generație de vaccinuri: ARNm și funcționalitatea plug-and-play
Toate strategiile folosite vreodată în vaccinologie au fost explorate în ultimul an. Pentru adresarea nevoilor pandemiei s-a validat un nou tip de tehnologie care are la baza acizi nucleici, nu proteine virale. Pandemia COVID-19 a demonstrat că procesul de dezvoltare a unui produs medical inovator poate fi accelerat fără a se compromite siguranța. Folosirea secvențierii de nouă generație, a sistemelor de tip reverse genetics și a tehnologiei digitale elimină mulți pași clasici din dezvoltarea vaccinurilor. Design-ul ARNm poate fi obținut în 48 de ore, un vaccin candidat în câteva săptămâni și milioane de doze livrate la nivel global în maximum un an. Conceptul primelor vaccinuri autorizate a fost obținut in silico, folosind o copie digitală a virusului. Virusurile nu mai necesită să fie crescute în bioreactoare și nu mai este necesară o probă fizică pentru a iniția producerea unui vaccin. Companiile de biotehnologie pot dezvolta un vaccin pornind de la un set instrucțiuni genetice – ARN sintetic – pe care organismul uman le va utiliza pentru a produce antigenul de interes. Vaccinurile ARNm funcționează după principiul plug-and-play, în cazul în care o nouă tulpină virală apare, un vaccin poate fi obținut în mai puțin de 6 săptămâni, ca un software nou folosit pe același sistem de operare.
Mai multe detalii despre cum funcționează tehnologia ARNm și care este potențialul în alte arii terapeutice, în materialul următor din seria State of Innovation 2021 – raportul anual realizat de Centrul pentru Inovație în Medicină.
Citește și:
- Știința întâlnește Politicienii: lansarea Raportului State of Innovation 2018 în Parlamentul României
- “Știința întâlnește Politicienii”: lansarea Raportului Anual State of Innovation 2019, realizat de Centrul pentru Inovație în Medicină
- State of Innovation: Dr. Marius Geantă vorbește despre biomarkeri și diagnostic de precizie

