UPDATE. Elecsys, testul serologic de înaltă precizie, autorizat în regim de urgență de FDA și disponibil în Europa sub marcaj CE. Diagnosticul COVID-19: Cine, când și prin ce metodă trebuie testat?
UPDATE 3 mai 2020. Testul serologic Elecsys Anti-SARS-CoV-2 (Roche) a fost aprobat pentru utilizare în statele care acceptă marca IVD CE (printre care și România și celelalte state europene) și în Statele Unite (procedura specială de urgență EUA). Acest test este capabil să identifice anticorpii specifici, formați de organism, în urma contactului cu virusul SARS-CoV-2. Testul poate fi efectuat cu ajutorul sistemelor de tip cobas e și conduce la rezultat în 18 minute. Pot fi efectuate până la 300 de teste pe oră.
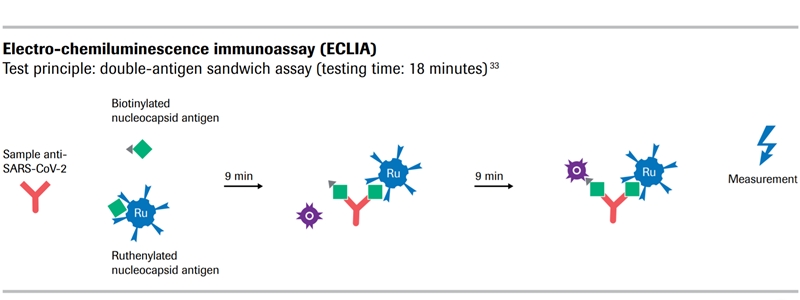
Testul Elecsys Anti-SARS-CoV-2 identifică prezența anticorpilor de tip IgM și IgG, direcționați contra nucleocapidei virale. Sensibilitatea testului a fost verificată cu probe prelevate de la pacienți cu COVID-19, confirmat prin testul diagnostic PCR. La 14 zile de la confirmarea PCR, sensibilitatea testului este de 100% (toate probele pozitive au fost identificate ca atare). În plus, printre pacienții testați ulterior, vindecați de COVID-19 (test PCR negativ), testul Elecsys Anti-SARS-CoV-2 continuă să identifice anticorpi (ceea ce ar sugera o seroconversie durabilă).
Specificitatea testului a fost verificată cu ajutorul probelor prelevate de la pacienți care nu au intrat în contact niciodată cu SARS-CoV-2 (probe prelevate înainte de decembrie 2019). Specificitatea a fost de 99.81%, și de 100% la pacienții cu diagnostic confirmat PCR de infecție cu coronavirusurile care produc răceala comună – ceea ce demonstrează că nu există riscul de fals pozitivi printre persoanele care au intrat în contact cu alte specii de coronavirus (nu există cross-reactivitate).
Cel mai precis test serologic, dezvoltat până în acest moment, a fost aprobat în Uniunea Europeană și în Statele Unite ale Americii
UPDATE 27 aprilie 2020. Un nou test serologic, dezvoltat de compania Abbott, a primit aprobare de utilizare în UE (Certificarea IVD CE) și în SUA (Emergency Use Authorisation) pentru a detecta anticorpii dezvoltați de organism împotriva noului coronavirus SARS-CoV-2. Testul poate fi efectuat cu ajutorul sistemelor de laborator ARCHITECT i1000SR și i2000SR, care au o capacitate de testare de 100-200 teste pe oră.
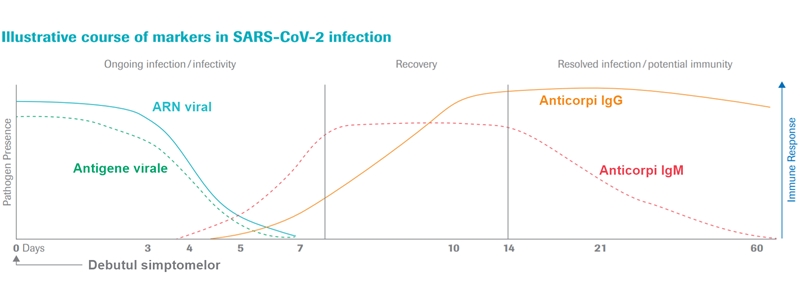
Noul test identifică prezența anticorpilor de tip IgG – anticorpi care se dezvoltă la o perioadă mai mare de la infecție (spre deosebire de IgM, cu apariție mai precoce) și pot persista timp de săptămâni, luni sau ani în organism. Prin testarea populației, poate fi înțeleasă epidemiologia infecției cu SARS-CoV-2 – studii preliminare sugerează că COVID-19 este de zeci de ori mai răspândit decât ar indica testele diagnostice PCR.
Se raportează că noul test are o specificitate și sensibilitate de 99%, superioară altor teste disponibile momentan. Astfel, prin aplicarea testului pe probe care conțin alte tipuri de anticorpi (autoimuni, contra altor virusuri și bacterii), a reieșit o specificitate de 99.107%. În plus, prin testarea unor probe lipsite de anticorpi anti SARS-CoV-2, testul a demonstrat o sensibilitate de 99,63%. În cazul testării unor probe provenite de la pacienți cu COVID-19 (confirmați prin testare PCR), testul serologic a condus la un rezultat pozitiv într-o proporție de 86.36% (la 8-13 zile post debutul simptomelor), și într-o proporție de 100%, la pacienții simptomatici de minimum 14 zile.
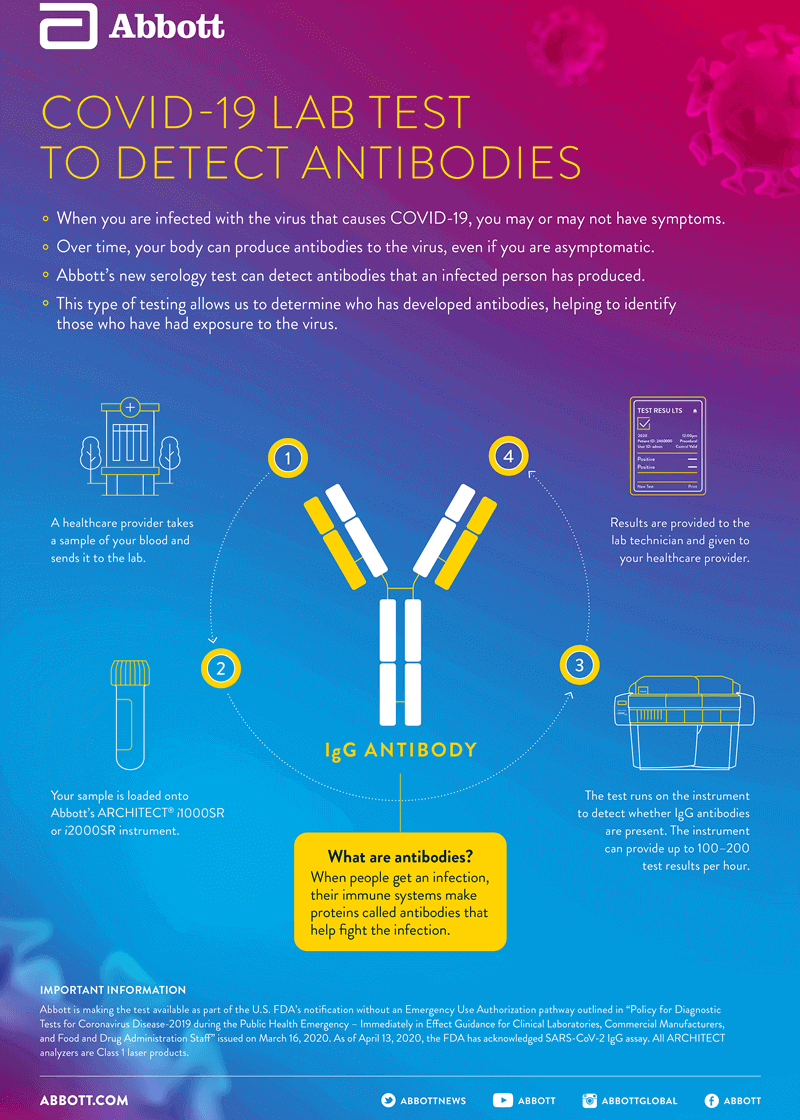
Infografic cu procedeul prin care se poate identifica prezența anticorpilor specifici noului coronavirus în organism. Sursa foto Abbott
Testul serologic, în dezvoltare de către Siemens Healthineers, are o sensibilitate și specificitate preconizată de 99%
UPDATE 24 aprilie 2020. Un nou test serologic de identificare a anticorpilor contra SARS-CoV-2 este în proces de a fi dezvoltat de către compania Siemens Healthineers. Acest test poate identifica atât anticorpii de tip IgM, cât și cei de tip IgG, iar sensibilitatea și specificitatea sunt de 99%, spre deosebire de alte teste serologice aprobate, care conferă o precizie mai scăzută procesului diagnostic.

Testul poate fi efectuat cu ajutorul sistemelor de analiză Atellica® Solution, care poate prelucra 440 probe pe oră și conduce la rezultat în 14 minute, și ADVIA Centaur® XP și XPT, care pot prelucra 240 de probe pe oră și conduc la rezultat în 18 minute. Cel mai probabil, testul va fi disponibil la sfârșitul lunii mai 2020, iar compania a înaintat cererea de aprobare a testului în Statele Unite (procedura specială de urgență EUA) și în Uniunea Europeană (certificarea IVD CE).
Testele serologice sunt esențiale în înțelegerea epidemiologiei virale și identificarea retrospectivă a cazurilor asimptomatice sau paucisimptomatice – care se estimează că reprezintă o proporție importantă din totalul cazurilor de COVID-19. Datorită dinamicii anticorpilor (aceștia apar la mai multe zile de la debutul clinic al bolii și nu se cunoaște cu exactitate persistența lor în organism), testele serologice nu pot confirma diagnosticul, ci doar susține rezultatele obținute prin testarea PCR. Testele serologice de înaltă precizie, precum cel anunțat de Siemens Healthineers, pot contribui la conturarea unui tablou corect al epidemiologiei infecției cu noul coronavirus.
Primul test diagnostic COVID-19 care poate analiza probe prelevate direct de către pacient
UPDATE 21 aprilie 2020. Administrația Alimentelor și Medicamentelor din Statele Unite (FDA) a aprobat primul test diagnostic pentru infecția cu SARS-CoV-2 care permite prelevarea probei la domiciliul pacientului, de către acesta.
Acest test, de tip PCR, este produs de LabCorp și a fost deja aprobat de FDA, prin procedura specială de urgență, pentru utilizarea uzuală (prelevarea și analiza probei în cadrul unei unități medicale). Extinderea de aprobare permite prelevarea probei care conține virusul atât de către un cadrul medical (prin prelevarea de secreții nazofaringiene, orofaringiene, spută, aspirate din tractul respirator inferior sau superior, lavaj bronhoalveolar), cât și de către pacient, la domiciliu, prin prelevarea de secreții nazale. Detecția virală, prin PCR, se efectuează în continuare în laboratorul spitalului, echipat corespunzător pentru identificarea ARN-ului viral.
“Pe parcursul acestei pandemii am încurajat și facilitat dezvoltarea de teste, pentru a oferi pacienților diagnosticul corect și rapid. În special, ne-am concentrat asupra metodelor de prelevare la domiciliu, pentru a ne asigura că prezintă aceeași acuratețe și siguranță ca metodele de prelevare din cadrul serviciilor medicale. În total, am autorizat prin procedura de urgență 50 de teste diagnostice și alți 350 de dezvoltatori de teste și-au exprimat interesul în acest domeniu,” a declarat comisarul FDA dr. Stephen M. Hahn.
Un nou test serologic a fost dezvoltat și este în curs de aprobare în UE și SUA
UPDATE 18 aprilie 2020. Un nou test serologic, Elecsys Anti-SARS-CoV-2, a fost dezvoltat de către compania Roche și ar putea fi disponibil în UE, Elveția și Turcia, de la începutul lunii mai, pe baza certificării CE. Acesta este în curs de evaluare FDA (Food and Drug Administration) printr-o procedură specială (EUA – Emergency Use Authorization) pentru a fi disponibil și în Statele Unite ale Americii.
Compania estimează că va putea produce zeci de milioane de teste până în iunie, acestea putând fi folosite de laboratoare din întreaga lume cu ajutorul sistemelor tip cobas. Imunotestarea prin Elecsys Anti-SARS-CoV-2 detectează in vitro anticorpii SARS-CoV-2 din probe de sânge. În funcție de modelul folosit, se vor putea analiza până la 300 de teste pe oră. Rezultatul unui test este disponibil în aproximativ 18 minute.
Testele serologice nu sunt diagnostice, ci sunt dezvoltate și validate pentru supravegherea epidemiologică a populației. Deoarece nu toate personale infectate SARS-CoV-2 sunt testate molecular, rezultatele testelor serologice ajută cercetătorii să estimeze numărul de persoane infectate. Pe baza acestor tipuri de date se iau deciziile de către autoritățile naționale și internaționale.
Primul test serologic de identificare a anticorpilor contra SARS-CoV-2 a fost aprobat de către FDA
UPDATE 1 aprilie 2020. Administrația Alimentelor și Medicamentelor (FDA) din SUA a acordat prima aprobare, prin procedură de urgență, unui test serologic de identificare a infecției cu SARS-CoV-2 (qSARS-CoV-2 IgG/IgM Rapid Test, produs de compania Cellex). Acest test poate detecta în probe de sânge anticorpii de tip IgM și IgG, produși de organismul uman drept răspuns la infecția cu coronavirusul SARS-CoV-2. Anticorpii de tip IgM apar precoce pe parcursul unei infecții, iar pozitivarea testului pentru aceștia indică faptul că pacientul are sau a avut recent o infecție activă cu SARS-CoV-2, iar IgG apar în organism la 7-10 zile de la infectare. Prezența anticorpilor de tip IgG nu exclude pacienții cu infecții active, care pot fi încă contagioși. În plus, nu se cunoaște durata de timp maximă în care anticorpii pot fi detectați, după infecție, iar un rezultat negativ nu exclude prezența virusului – pacienții suspecți de COVID-19 trebuie testați ulterior prin metoda PCR. Conform testelor realizate de compania producătoare, testul Cellex are o sensibilitate de 93,8% și o specificitate de 96%.
Testul rapid Cellex qSARS-CoV-2 IgG/IgM nu este încă aprobat în Uniunea Europeană (nu are certificare CE), însă alte două teste serologice au primit deja certificarea CE (Kitul de detecție de anticorpi SARS-CoV-2 IgG/IgM, produs de Beroni Group și Anti-SARS-CoV-2 ELISAs (IgA & IgG), produs deEuroimmun/PerkinElmer).
Deoarece acest virus este recent apărut în populația umană, nu se cunoaște cu exactitate comportamentul său – cât de rapid reacționează sistemul imunitar prin producția de anticorpi, cât timp pot fi detectați acești anticorpi în sânge, dacă toate persoanele infectate produc anticorpi detectabili și dacă titrul lor se corelează cu simptomatologia. De aceea, diagnosticul se bazează în continuare pe teste PCR de identificare directă a virusului în tractul respirator.

UPDATE 27 martie 2020. Administrația Alimentelor și Medicamentelor (FDA) din SUA a aprobat, prin procedură de urgență, testul ID NOW COVID-19, cel mai rapid test care poate fi realizat aproape de locul de îngrijire al pacientului (point-of-care testing) și care conduce la rezultat în 5 minute (în cazul în care proba este negativă, rezultatul apare în 13 minute).
Acest test diagnostic este de tip PCR și poate identifica virusul SARS-CoV-2 din probe nazofaringiene. Kitul de testare poate fi folosit pe dispozitivele ID NOW (produse de aceeași companie, Abbott), care au avantajul unor dimensiuni reduse care contribuie, astfel, la un diagnostic rapid. ID NOW COVID-19 este cel mai recent test dintre cele 19 aprobate prin procedura de urgență (EUA – Emergency Use Authorization) de către FDA. Peste 110 laboratoare lucrează la dezvoltarea de noi teste diagnostice pentru SARS-CoV-2, conform FDA.

O nouă definiție de caz suspect de infecție cu SARS-CoV-2
UPDATE 27 martie 2020.Pentru o utilizare rațională a kiturilor de testare și a resurselor spitalicești în general, este important să recunoaștem rapid persoanele suspecte de COVID19. Definiția cazului suspect a fost elaborată de Centrul European de Prevenire și Control al Bolilor (ECDC), și a fost adaptată de către Centrul National de Supraveghere și Control al Bolilor Transmisibile, din cadrul Institutului Național de Sănătate Publică România.
Pe data de 27 martie 2020, definiția de caz suspect a fost modificată, adăugând o situație clinică care ridică suspiciunea de COVID-19, la cele trei situații deja anunțate:
- Pacient cu infecție respiratorie acută, fără altă etiologie care să explice pe deplin tabloul clinic, cu istoric de călătorie sau ședere într-o țară/regiune cu transmitere comunitară, în perioada de 14 zile anterioare debutului;
- Pacient cu infecție respiratorie acută, cu contact apropiat cu un caz confirmat COVID-19 în perioada de 14 zile anterioară debutului.
- Pacient cu infecție respiratorie acută severă, fără altă etiologie care să explice pe deplin tabloul clinic;
În plus, se consideră caz suspect de COVID-19 și:
4. Pacient cu pneumonie, fără altă etiologie care să explice pe deplin tabloul clinic.
FDA aprobă cel mai rapid test diagnostic pentru COVID-19 de până acum
UPDATE 21 martie 2020. Administrația Alimentelor și Medicamentelor (FDA) din SUA a aprobat, prin procedura de urgență (EUA – Emergency Use Authorization) primul test de diagnostic al COVID-19 care poate fi realizat aproape de locul de îngrijire al pacientului (point-of-care testing) și care conduce la rezultat în 45 de minute. Cepheid Xpert Xpress SARS-CoV-2, produs de compania Cepheid, este un test de tip real time PCR, care poate fi efectuat cu ajutorul celor 23.000 de sisteme GeneXpert® System care există deja în laboratoare publice sau private. Testul analizează probe de exsudat nazofaringian, iar rezultatele rapide contribuie la gestionarea corectă, în timp real, a cazurilor suspecte de COVID-19. Acest test nu este încă aprobate în Uniunea Europeană.
În ceea ce privește aprobarea testelor diagnostice în UE, testul AccuPower SARS-CoV-2 Real-Time RT-PCR Kit, produs de firma Bioneer, a primit certificarea CE (CE-IVD- test de diagnostic in vitro, conform cu standardele europene), iar România este printre primele țări care au aprobat acorduri de furnizare a testelor, pentru a fi utilizate în 20 de unități medicale publice din țară.
Infecția cu SARS-CoV-2, COVID19, care a fost declarată drept pandemie de către Organizația Mondială a Sănătății, poate fi prevenită prin respectarea riguroasă a regulilor de igienă și a măsurilor de distanțare socială impuse.
Pe lângă eforturile cercetătorilor de a dezvolta un tratament sau vaccin specific împotriva bolii, o verigă importantă în lupta contra SARS-CoV-2 este diagnosticul corect, identificat în mod rapid.
Din acest articol puteți afla:
- cum se pune diagnosticul de infecție cu SARS-CoV-2
- care sunt grupele de persoane care trebuie testate și când
- care este tehnica prin care se realizează testarea
- ce aduc nou primele teste comerciale, aprobate de FDA
OMS: protocolul de diagnostic al COVID19
Conform ghidului elaborat de Organizația Mondială a Sănătății, publicat pe data de 2 martie 2020, etapa esențială în diagnosticul COVID19 este identificarea virusului SARS-CoV-2. Pentru aceasta, se recomandă prelevarea de probe respiratorii superioare (exsudat nazal sau faringian), preferabil împreună cu sange și probe respiratorii inferioare (spută sau lavaj bronhoalveolar – în cazul formelor grave de boală). Ulterior, se recomandă identificarea virală prin metoda rRT-PCR (reacție de polimerizare în lanț). Proba se consideră pozitivă dacă se detectează două fragmente genetice specifice coronavirusurilor, dintre care unul specific SARS-CoV-2.
Până în acest moment nu au fost dezvoltate teste serologice, de detecție a anticorpilor contra SARS-CoV-2, însă se recomandă recoltarea probelor de sânge și stocarea adecvată a acestora, până când va fi dezvoltat un astfel de test, și va putea fi înțeleasă mai bine răspândirea infecției în populație și răspunsul serologic uman.
Cine trebuie să fie testat și când
Potrivit Ghidului Organizației Mondiale a Sănătății, “decizia de a realiza un test trebuie să se bazeze pe factorii clinici și epidemiologici existenți și pe evaluarea probabilității infecției. Testarea rRT-PCR a persoanelor asimptomatice sau a contacților cu simptome ușoare poate fi luată în considerare pentru evaluarea persoanelor care au fost în contact cu un pacient diagnosticat cu COVID-19. Protocoalele de screening trebuie adaptate situației locale”.
Situația testării în România: 2.929 teste efectuate până pe 14 martie
Kiturile de rRT-PCR sunt, astfel, o resursă indispensabilă în gestionarea corectă a epidemiei. În România, în urma inventarierii stocului, autoritățile declară că există suficiente kituri de testare, care vor fi suplimentate pe măsură ce sunt utilizate. Sunt 7 centre în care se realizează testarea, din București, Cluj-Napoca, Iași, Timișoara, Constanța și Craiova. Până pe data de 12 martie, au fost lucrate 1.921 de teste, dintre care majoritatea au condus la rezultate negative. Până pe 14 martie, numărul de testări efectuate a ajuns la 2.929, dintre care 2.827 au avut rezultat negativ. Până pe 16 martie, numărul de teste efectuate s-a ridicat la 3.708, dintre care 3.540 cu rezultat negativ. Până pe 28 martie numărul de teste efectuate a ajuns la 19.663.
Primele teste comerciale, autorizate pentru folosire prin procedura de urgență
FDA (Food and Drug Administration) a autorizat pe 13 martie 2020, printr-o procedură specială (EUA – Emergency Use Authorization), primul test comercial pentru utilizarea de urgență pentru diagnosticarea infecției cu SARS-CoV-2. Procedura este excepțională și nu înseamnă o aprobare clasică de punere pe piață, ci vine ca un răspuns al autorităților de reglementare și a industriei față de urgența de sănătate publică reprezentată de pandemia COVID-19. Testul poate fi folosit și în statele care acceptă marca CE și în care sunt confirmate cazuri de infecție, deci și în România.
Acordul FDA a venit la numai 24 de ore de când producătorul, compania Roche, a depus solicitarea. De la începutul crizei, FDA a lucrat cu un număr de peste 60 de companii sau centre academice pentru dezvoltarea testelor diagnostice pentru noul coronavirus.
Testul se numește cobas® SARS-CoV-2 Test, iar kit-ul poate fi folosit pe sistemele de tip cobas 6800 și 8800, care există deja în laboratoare publice sau private, inclusiv din România. Pentru analiză, se folosesc probe din exsudatele nazale sau faringiene, iar rezultatul poate fi disponibil în doar trei ore jumătate. Pot fi analizate simultan 96 de probe, iar în 24 de ore pot fi analizate între 1.440 sau 4.128 de probe, în funcție de dispozitivul de testare utilizat.
Într-un comunicat de presă, compania producătoare afirmă că “vom avea disponibile milioane de teste pe lună, care pot fi folosite pe sistemele cobas 6800 și 8800″.
În aceeași zi, în urma acestei proceduri de urgență, FDA a aprobat al doilea test comercial pentru detecția SARS-CoV-2, produs de compania Thermo Fischer. Acest test conduce la diagnosticul infecției SARS-CoV-2 în decurs de 4 ore de la sosirea probei în laborator. Ulterior, pe 26 martie, acest test a primit și certificarea CE, care permite utilizarea sa în Uniunea Europeană (CE-IVD– test de diagnostic in vitro, conform cu standardele europene),
În continuare, FDA a aprobat testele Panther Fusion SARS-COV-2 Assay (produs de Hologic) și COVID-19 RT-PCR test (produs de Laboratory Corporation of America), și a anunțat că peste 90 de companii și laboratoare au demarat procesul de aprobare de urgență a testelor diagnostice SARS-CoV-2.
Ce presupune diagnosticarea prin RT-PCR?
Identificarea genotipului SARS-CoV-2 s-a realizat în timp record, la doar o lună de la primele cazuri de pneumonie din Wuhan, China. Primele teste diagnostice, de identificare a virusului în probe biologice, au fost dezvoltate o săptămână mai târziu. Testul diagnostic al SARS-CoV-2 este un test de tip RT-PCR (reacția de polimerizare în lanț), la care se adaugă revers transcriptaza și identificarea în timp real (cu ajutorul unor markeri fluorescenți). Astfel, din proba biologică obținută de la pacient se obține o probă purificată, care conține tot materialul genetic al virusului.
Deoarece SARS-CoV-2 este un virus de tip ARN (informația genetică e codificată sub formă de acid ribonucleic) este necesară adăugarea enzimei revers transcriptază, care transformă fragmentele de ARN în secvențele corespunzătoare de ADN. Ulterior, prin procedeul RT-PCR, secvențele ADN sunt multiplicate, astfel încât ating o concentrație suficientă pentru a fi identificate. Ulterior, se adaugă un marker fluorescent, care recunoaște în mod exclusiv secvențe genetice specifice virusului SARS-CoV-2. Astfel, proba este considerată pozitivă dacă apare fluorescența (adică prezența virusului e confirmată de existența secvențelor genetice unice).
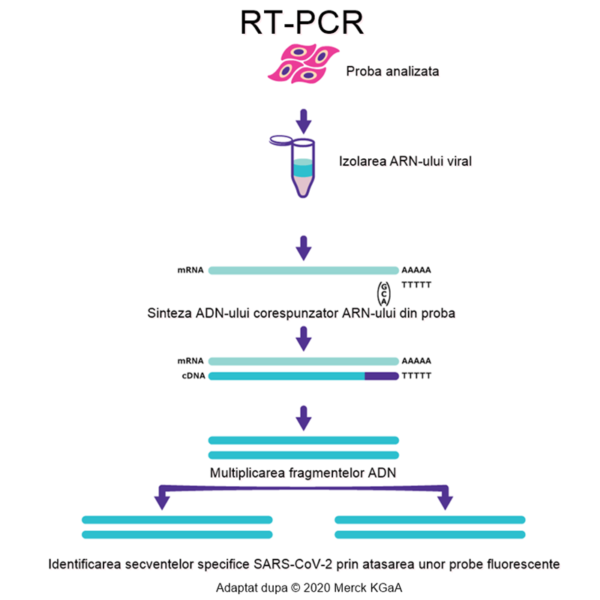
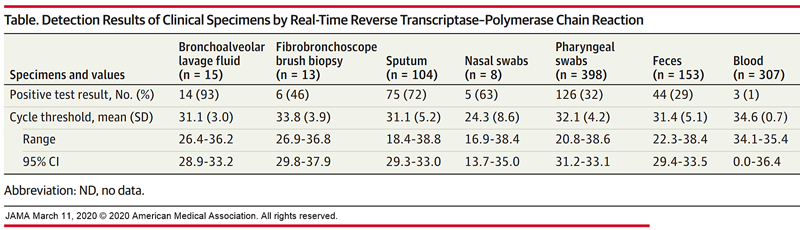
În ce regiuni ale organismului se regăsește virusul?
Fiind un virus cu transmitere aeriană, cel mai frecvent poate fi identificat la pacienți în secrețiile respiratorii: exsudat nazal sau faringian, spută, lavaj bronhoalveolar sau probe de biopsie endoscopice. Toate acestea sunt metode de colectare a secrețiilor provenite din plămâni și eliberate din organism și au fost colectate mai multe probe, din diferite localizări, de la fiecare pacient. Detecția SARS-CoV-2 a variat între 32% (exsudatul faringian) și 93% (lavajul bronhoalveolar). În plus, coronavirusul viu (care poate fi transmis) a fost detectat și în proba de fecale (29% dintre probe), foarte rar în sângele pacienților (1% dintre probe), iar probele de urină au fost toate negative.
Definiția de caz: criteriile conform cărora o persoană este suspectă de COVID19
Pentru o utilizare rațională a kiturilor de testare și a resurselor spitalicești în general, este important să recunoaștem rapid persoanele suspecte de COVID19. Definiția cazului suspect a fost elaborată de Centrul European de Prevenire și Control al Bolilor (ECDC), și a fost adaptată de către Centrul National de Supraveghere și Control al Bolilor Transmisibile, din cadrul Institutului Național de Sănătate Publică România. Pe data de 23 martie 2020, definiția de caz suspect a fost modificată, descriind trei situații diferite care ridică suspiciunea de COVID-19:
- Pacient cu infecție respiratorie acută (debut brusc al cel puțin unuia dintre următoarele: tuse, febră, dificultăți în respirație), care în plus:
- Nu prezintă o altă etiologie care să explice pe deplin tabloul clinic;
- Are istoric de călătorie sau ședere într-o țară/regiune cu transmitere
comunitară, în perioada de 14 zile anterioare debutului.
- Pacient cu infecție respiratorie acută, care în plus are:
- contact apropiat cu un caz confirmat COVID-19 în perioada de 14 zile anterioară debutului.
- Pacient cu infecție respiratorie acută severă (prezența tuturor simptomelor principale: tuse, febră, dificultăți în respirație), care în plus:
- necesită spitalizare peste noapte;
- Nu prezintă o altă etiologie care să explice pe deplin tabloul clinic.
În urma realizării testelor PCR pentru identificarea SARS-CoV-2, cazul suspect poate deveni:
- Caz confirmat: confirmarea de laborator a infecției cu SARS-CoV-2, indiferent de semnele și simptomele clinice.
Contactul apropiat are următoarele definiții, legătura epidemiologică având loc în perioada de 14 zile anterioară debutului cazului inițial:
- Persoana care locuiește în aceeași gospodărie cu un pacient cu COVID-19;
- Persoana care a avut contact fizic direct (ex. strângere de mână neurmată de igiena mâinilor) sau contact direct neprotejat cu secreții infecțioase ale unui caz de COVID-19 (ex. în timpul tusei, atingerea unor batiste cu mâna neprotejată de mănușă);
- Persoana care a avut contact față în față sau s-a aflat în aceeași încapere, la o distanță mai mică de 2 m și pe o durată de peste 15 minute;
- Persoana din rândul personalului medico-sanitar sau altă persoană care acordă îngrjire directă unui pacient cu COVID-19, sau o persoană din rândul personalului de laborator care manipulează probe recoltate de la un pacient cu COVID-19, fără portul corect al echipamentului de protecție;
- Persoana care a avut contact în avion cu un caz de COVID-19 și care a stat pe unul dintre cele 2 rânduri în orice direcție față de caz, persoane care au călătorit împreună cu cazul sau care i-au acordat îngrijire în avion, membri ai echipajului care au servit în zona in care s-a aflat cazul;
- Dacă severitatea simptomelor sau deplasarea cazului în avion indică o expunere mai extinsă, vor fi considerați contacți apropiați toți pasagerii din zona respectivă din avion, sau chiar toți pasagerii din avion.
Pentru informațiile corecte și verificate, accesați stirioficiale.ro, primul website lansat de Code for Romania Task Force, în parteneriat cu Guvernul României prin Autoritatea pentru Digitalizarea României și Departamentul pentru Situații de Urgență.
Citește și:
- #VociCuAutoritate. Organizația Mondială a Sănătății declară PANDEMIA COVID-19. Inspectoratul pentru Situații de Urgență: cum ne protejăm pe noi și pe cei din jur de infecția cu noul coronavirus
- Vaccin împotriva COVID-19: 37 de companii au început dezvoltarea, în întreaga lume. Aprilie 2020: primul vaccin în studiu clinic pe oameni. Când ar putea fi disponibil pe scară largă?
- Coronavirusul SARS-CoV-2: Care este profilul persoanelor aflate la risc înalt de a dezvolta forme severe COVID19?

