FDA aprobă prima terapie CAR-T pentru tratamentul limfomului cu celule de manta: brexucabtagene autoleucel
Administrația Alimentelor și Medicamentelor din SUA (FDA) a aprobat prin procedură accelerată Tecartus (brexucabtagene autoleucel), prima terapie CAR-T (chimeric antigen receptor T-cell) pentru tratamentul adulților cu limfom cu celule de manta (MCL-mantle cell lymphoma), refractar sau recidivat. În plus, Tecartus a primit din partea FDA statut prioritar (Priority Review) și pe cel de medicament inovator (Breakthrough Therapy Designation). În continuare se vor derula studii clinice care vor verifica și descrie beneficiile clinice ale acestuia.
În Uniunea Europeană, Tecartus este în proces de evaluare prioritară pentru tratamentul MCL recidivat sau refractar.
Aprobarea are la bază rezultatele preliminare ale studiului în desfășurare ZUMA-2. În cadrul acestuia, 87% dintre pacienți au răspuns la o singură administrare a Tecartus. La 62% dintre participanți s-a obținut răspuns complet.
„Aceasta este prima aprobare a unei terapii CART-T în tratamentul limfomului cu celule de manta și reprezintă o nouă frontieră în tratamentul acestei boli. În ultimul deceniu, s-au realizat progrese mari în înțelegerea acestei patologii și creșteri ale numărului de studii clinice pentru pacienți, ceea ce sperăm că va continua să îmbunătățească strategiile și opțiunile terapeutice pentru limfomul cu celule de manta”- Meghan Gutierrez, director executiv Lymphoma Research Foundation.

Tecatus este disponibil doar prin intermediul unui program special care permite evaluarea raportului risc beneficiu. Acesta presupune analizarea posibilelor reacții adverse severe: sindrom de eliberare de citokine de grad înalt (raportat la 18% dintre pacienți) sau toxicitate neurologică severă (raportată la 37% dintre pacienți): encefalopatii, afazie, convulsii. Programul este obligatoriu pentru autorizarea unui centru pentru a oferi terapia. Acesta va informa și educa clinicienii asupra riscurilor asociate Tecarus.
Tecartus va fi produs în unitatea de producție comercială Kite, din El Segundo, California. În cadrul studiului ZUMA-2, rata de succes a producției a fost de 96%. Durata mediană de la leucafereză la livrarea produsului a fost de 15 zile. O perioada de producție scurtă este critică, mai ales la pacienții cu boală avansată sau la cei în stare gravă sau cu risc mare de progresie.
Studiul ZUMA-2
Studiul deschis, cu un singur braț, ZUMA-2, a înrolat 74 de pacienți cu MCL refractar sau recidivat, care au urmat anterior tratament chimioterapic cu antracicline sau bendamustine, sau terapie anti-CD-20 sau inhibitor tirozin-kinazic Bruton (ibrutinib sau acalabrutinib). Toți pacienții au fost urmăriți cel puțin 6 luni de la obiectivarea răspunsului. Durata mediană de urmărire nu a fost încă atinsă.
„În ciuda avansurilor promițătoare, există în continuare lipsuri în tratamentul pacienților cu MCL care progresează după terapia de primă linie. Mulți pacienți au boală cu risc înalt cu o probabilitate mai mare de a continua să progreseze chiar și după tratamente ulterioare. Disponibilitatea Tecartus ca prima terapie genică pentru pacienții MCL recidivat/refractar reprezintă o opțiune importantă cu o rată de răspuns de aproape 90% și posibile remisiuni de durată, conform primelor rezultate ale studiilor clinice”- Prof. Dr. Michael Wang, cercetător principal al studiului ZUMA-2, Universitatea Texas, Centrul Oncologic MD Anderson.
87% dintre pacienți (60) au răspuns la o singură infuzie Tecartus. 62% dintre pacienți au atins răspuns complet. Cele mai comune reacții adverse de grad înalt au fost anemie, neutropenie, trombocitopenie, pirexie, hiponatremie, hipertensiune, infecție cu agent nespecificat, pneumonie, hipocalcemie și limfopenie.
Despre limfomul cu celule de manta
MCL este o formă rară de limfom non-Hodgkin, reprezentând aproximativ 7% dintre cazurile de LNH din Europa, cu o incidență anuală de 5-8 cazuri la milion. Tipic, se dezvoltă din celule din zona de manta a ganglionilor limfatici. Afectează cel mai adesea bărbații de peste 60 de ani. Durata mediană de supraviețuire cu tratament modern intens este de 8-10 ani.
Despre Tecartus (brexucabtagene autoleucel)
Tecartus reprezintă un tratament autolog, CAR-T, anti-CD19. Terapia CAR-T presupune reprogramarea celulelor imune ale pacientului să lupte împotriva cancerului și este considerat un tratament cu potențial curativ. Reprezintă o nouă dimensiune a personalizării tratamentului în oncologie, fiind în același timp terapie genică, terapie celulară și imunoterapie. Citește aici mai multe despre terapia CAR-T.
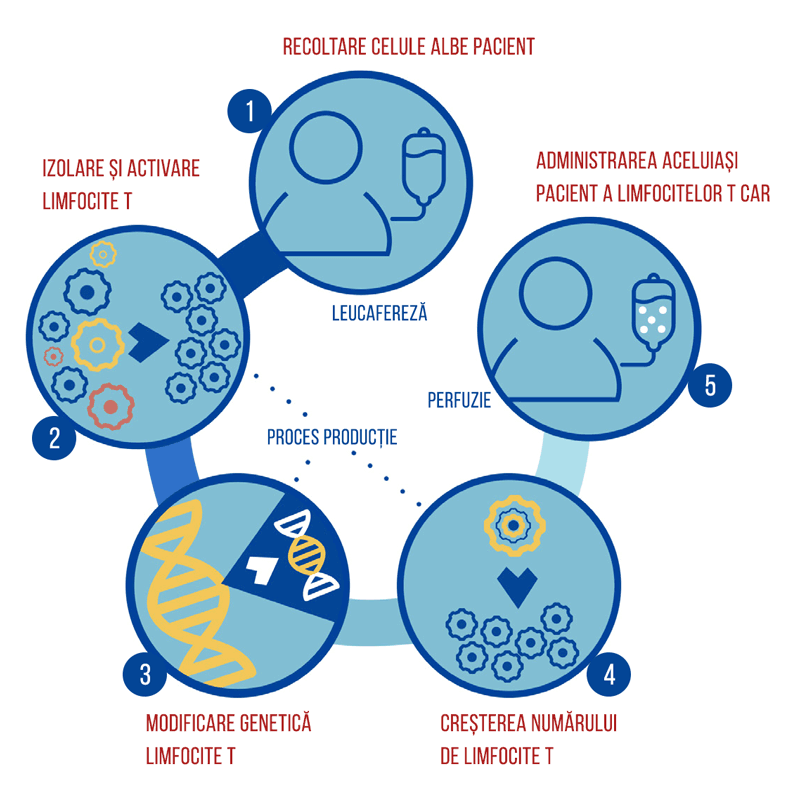
Există studii de fază 1/2 în desfășurare asupra eficienței Tecartus în tratamentul leucemiei limfoblastice acute și a leucemiei limfocitare cronice.
Citește și:
- #EHA2020. Terapia CAR-T Liso-Cel induce o rată generală de răspuns de 89% în limfomul non-Hodgkin cu celule B recidivant sau refractar
- Terapiile CAR-T, o nouă dimensiune a personalizării tratamentului oncologic: cum diferă față de terapiile clasice și care sunt progresele în managementul cancerelor hematologice
- #ASH19. Yescarta crește ratele de supraviețuire la 3 ani pentru pacienții cu limfom difuz cu celulă mare tip B

