#ASCO20. Studiul TAPUR: date din viața reală confirmă beneficiile tratamentului cu olaparib pentru cancerul de prostată avansat și cancerul pancreatic, BRCA-pozitive
Rezultatele pozitive obținute în două cohorte ale studiului TAPUR oferă dovezi din viața reală care sprijină datele din studiile clinice și demonstrează rolul important al terapiei țintite olaparib în tratamentul cancerului de prostată avansat și al cancerului pancreatic cu mutații BRCA1/2-inactivatoare. Noile rezultate ale studiului TAPUR au fost prezentate în cadrul Întâlnirii Anuale a Societății de Oncologie Clinică din Statele Unite ASCO20, desfășurate virtual anul acesta, în perioada 29-31 mai.
În două cohorte mici, tratamentul cu olaparib a dus la răspunsuri obiective sau la boală stabilă timp de cel puțin 16 săptămâni la mai mult de două treimi (68%) dintre pacienții cu cancer de prostată avansat BRCA-pozitiv și aproape o treime (31%) dintre pacienții cu cancer pancreatic avansat și mutații inactivatoare BRCA1/2.
„Este plauzibil ca o terapie țintită care este eficientă și a fost aprobată deja pentru un tip de cancer cu o mutație specifică să fie eficientă și pentru alte tipuri de cancer cu aceeași mutație. Studiul TAPUR oferă date de la o populație mai largă de pacienți decât cea inclusă în studiile care au vizat olaparib în aceste indicații, și susține siguranța și eficacitatea acestei terapii la pacienții cu tratament prealabil extins”, a declarat Chief Medical Officer și vicepreședintele executiv al ASCO, Dr. Richard L. Schilsky.
Olaparib în cancerul de prostată
Primul studiu a inclus 29 de pacienți cu cancer de prostată avansat, cu mutație germinală sau mutații somatice BRCA1/2-inactivatoare. Acești pacienți cu boală măsurabilă, funcție adecvată a organelor și status de performanță ECOG de 0–2, nu mai aveau alte opțiuni standard de tratament.
Pacienții au primit olaparib sub formă de capsule de 400 mg sau comprimate de 300 mg, de două ori pe zi. Tratamentul a fost continuat până s-a înregistrat progresia bolii.
Eficacitatea a putut fi evaluată la 25 de pacienți. Dintre aceștia, 68% au înregistrat fie răspuns obiectiv, fie boală stabilă timp de cel puțin 4 luni. Trei pacienți au avut cel puțin un eveniment advers de gradul 3 sau reacție adversă severă, posibil legate de tratamentul cu olaparib. Evenimentele adverse raportate au fost în concordanță cu prospectul medicamentului.
Aceste date susțin aprobarea recentă de către FDA a olaparib pentru tratamentul pacienților adulți cu cancer de prostată metastazat, rezistent la castrare, cu mutații genetice periculoase sau suspiciune de mutație de linie germinală sau mutație somatică a genei HRR (homologous recombination repair).
Olaparib în cancerul pancreatic
A doua cohortă a inclus 30 de pacienți cu cancer pancreatic avansat și mutații inactivatoare BRCA1/2, tratați anterior cu terapie pe bază de săruri de platină. Acești pacienți cu boală măsurabilă, funcție adecvată a organelor și status de performanță ECOG 0-2, nu mai dispuneau de opțiuni standard de tratament.
Pacienții au primit olaparib sub formă de capsule sau tablete, de două ori pe zi, până la progresia bolii.
Eficacitatea a putut fi evaluată la 26 de pacienți, dintre care 31% au obținut fie răspuns obiectiv, fie boală stabilă timp de cel puțin 4 luni. Patru pacienți au avut cel puțin un eveniment advers de gradul 3 sau efect advers sever, posibil legat de tratamentul cu olaparib. Evenimentele raportate au fost, de asemenea, în concordanță cu prospectul medicamentului.
Aceste constatări susțin aprobarea recentă de către FDA a olaparib pentru tratamentul de întreținere a pacienților adulți cu adenocarcinom pancreatic metastazat, cu mutație de linie germinală sau somatică BRCA1/2.
Ce este olaparib?
Inhibitorul PARP, olaparib (Lynparza), este deja aprobat în cazul tumorilor BRCA-pozitive, localizate la nivel mamar, ovarian, prostatic sau pancreatic.
Celulele cu modificări metabolice cauzate de mutația BRCA sunt sensibile la acțiunea acestei clase terapeutice, prin intermediul unei enzime de reparare a ADN-ului, denumită PARP (poly-adenosine diphosphate–ribose polymerase). În cazul tumorilor BRCA-pozitive, celulele tumorale utilizează frecvent calea enzimatică PARP pentru a repara genomul și pentru a se multiplica. Astfel, prin inhibarea PARP, olaparib împiedică proliferarea tumorilor BRCA-pozitive.
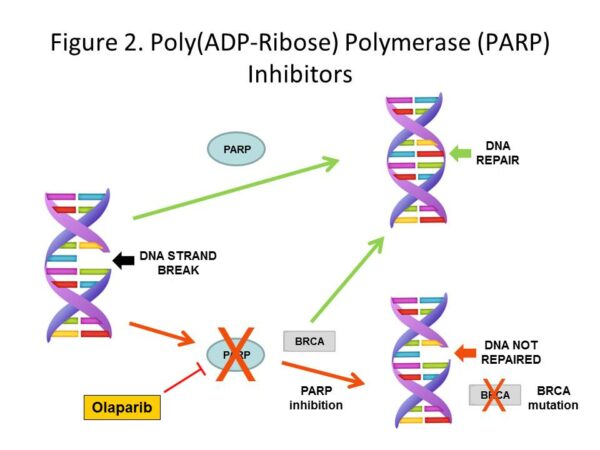
Mutația BRCA este cel mai frecvent asociată cu apariția cancerului mamar sau ovarian. 72% dintre femeile ce prezintă mutația BRCA1 dezvoltă cancer mamar până la vârsta de 80 de ani, iar procentul este de 69% pentru mutatia BRCA2. În afară de aceste tipuri tumorale, mutația BRCA reprezintă un factor de risc și pentru alte tumori.
Tumorile pancreatice cu mutații la nivelul genelor BRCA1 sau BRCA2 reprezintă o proporție scăzută din totalul acestor tumori (4-7%). În funcție de tipul mutației, riscul de cancer pancreatic este de 2 – 3 ori mai ridicat printre purtătorii mutației BRCA, față de populația generală. Tumorile pancreatice metastatice prezintă o agresivitate semnificativă: tratamentul actual conduce la o supraviețuire lipsită de progresie a bolii de aproximativ 6 luni, iar mai puțin de 10% dintre pacienți supraviețuiesc mai mult de 5 ani de la diagnostic.
Ce este special la studiul TAPUR?
Studiul TAPUR (Targeted Agent and Profiling Utilization Registry Study) este primul studiu clinic realizat de către Societatea Americană de Oncologie Clinică (ASCO) și se axează pe pacienții cu forme avansate de cancer, rămași fără opțiuni de tratament.
Studiul investighează dacă anumite terapii țintite specifice pot fi utile anumitor pacienți, pe baza profilului genomic specific al tumorilor, conducând astfel la o abordare terapeutică mai personalizată. TAPUR este un studiu tip „basket” (coș), care grupează tumorile în funcție de modificări genomice specifice, indiferent de locația de origine a cancerului.
Studiul TAPUR colectează date clinice despre terapiile țintite în tratamentul formelor de cancer care nu sunt aprobate în prezent de către FDA pentru a evalua posibilitatea unor indicații noi ale acestor medicamente. În plus, oferă șansa includerii în studii clinice, pacienților cu forme oncologice avansate, care prezintă modificări genetice tumorale care pot fi țintite prin medicamente integrate în studiul TAPUR. Pacienții sunt eligibili dacă nu mai prezintă răspuns la tratamentul standard sau nu pot beneficia de acesta din diverse motive.
În urmă cu un an, în cadrul întâlnirii anuale ASCO 2019, studiul TAPUR raporta rezultate pozitive în cazul cohortelor de pacienți cu cancer pulmonar non-microcelular și cancer de sân metastazat:
- Monoterapia cu palbociclib determină răspuns favorabil la pacienții cu cancer pulmonar non-microcelular (NSCLC) care prezintă modificări ale genei CDKN2A și care au fost intens tratați anterior;
- Pembrolizumab a demonstrat activitate antineoplazică în cazul pacienților cu cancer mamar metastazat care prezintă multiple mutații genetice tumorale și al cărui cancer a fost multiplu tratat anterior.
„Mulți dintre pacienții incluși în studiul TAPUR au încercat multiple opțiuni de tratament care nu au funcționat, așa că este încurajator să observăm activitate antitumorală la pacienții oncologici cu aceste modificări genetice. Este, însă, nevoie de cercetări ulterioare pentru a confirma eficacitatea terapiilor”, declara la acea vreme Dr. Richard L. Schilsky, ASCO Chief Medical Officer, FACP, FASCO.
În urmă cu 4 luni, în cadrul Simpozionului dedicat Cancerului Gastrointestinal, erau prezentate rezultatele altor trei cohorte din studiul TAPUR, oferind dovezi pentru potențialul beneficiu al mai multor terapii țintite în tratamentul cancerului colorectal avansat:
- Combinația pertuzumab/trastuzumab, eficientă în cancerul colorectal HER2-pozitiv;
- Combinația cobimetinib/vemurafenib crește speranța de viață în cancerul colorectal cu mutație BRAF V600E;
- Rezultate modeste pentru pembrolizumab în cancerul colorectal cu încărcătură mare a mutațiilor tumorale.
Astăzi, în studiul TAPUR sunt înrolați până la 1.900 de pacienți din peste 115 centre oncologice și spitale din SUA.
Citește și:
- Olaparib, aprobat de FDA pentru tratamentul de menținere a cancerului pancreatic metastatic BRCA-pozitiv
- #ASCO19. Olaparib dublează numărul de pacienți în remisiune, în cazul cancerului pancreatic metastatic, BRCA-pozitiv
- #ASCO20. Terapia de întreținere cu olaparib crește supraviețuirea în cancerul ovarian recidivat BRCA-pozitiv cu peste 1 an


