#ASCO22. Zenocutuzumab, o nouă terapie tumor agnostic demonstrează răspunsuri durabile în cancerele cu fuziuni NRG1
Zenocutuzumab, un anticorp bispecific anti-HER2/HER3, determină răspunsuri durabile la pacienți cu neoplasme solide avansate care prezintă fuziuni NRG1 și are un profil de siguranță foarte bun, conform celor mai recente rezultate din studiul de fază 1/2 eNRGy, prezentate la Întâlnirea Anuală a Societății Americane de Oncologie Clinică (ASCO 2022).
Cancerele care prezintă fuziuni NRG1 sunt asociate cu evoluții nefavorabile și răspuns slab la tratamentul standard și la primele generații de imunoterapii. Zenocutuzumab este un nou tip de imunoterapie bazată pe anticorpi sintetici care permite sistemului imun să țintească simultan proteinele HER2 și HER 3 de la nivelul celulelor tumorale. 34% dintre cele 79 de cazuri care au putut fi evaluate au atins răspunsuri obiective (tumorile au dispărut sau au fost diminuate în urma tratamentului). Anticorpul bispecific a demonstrat rezultate semnificative, independent de histologia tumorală. Cele mai importante răspunsuri s-au obținut în cazul anumitor subtipuri de cancer pancreatic și cancer pulmonar, cu opțiuni terapeutice extrem de limitate până acum.
Fuziunile NRG1 sunt rare (aproximativ 0,2% din cancerele solide), la fel ca și fuziunile NTRK, dar beneficiile demonstrate de noile tipuri de agenți terapeutici de tip tissue-agnostic, susțin importanța testării biomarkerilor pentru stabilirea diagnosticului de precizie. De asemenea, rezultatele demonstrate de zenocutuzumab sunt un argument în plus asupra extinderii accesului la secvențierea ARN pentru identificarea cancerelor caracterizate prin fuziuni genice (cum este și în cazul NTRK).
Aceste rezultate sunt o nouă dovadă a fezabilității studiilor cu grupuri reduse de pacienți, care pot fi recrutați rapid pe baza cunoașterii informațiilor legate de prezența biomarkerilor. Extinderea secvențierii de nouă generație a condus la identificarea de mutații rare care aduc schimbări majore în derularea studiilor clinice în oncologie.
În cadrul ASCO 2022 au fost prezentate și primele date din studiul de fază 2 CRESTONE în care a fost evaluat anticorpul monoclonal umanizat anti-HER3, seribantumab. Acesta a determinat o rată de răspuns de 33% și cu o rată de control a bolii de 92% la pacienții ale căror tumori prezintă fuziuni NRG1.
Studiul eNRGy
Până în ianuarie 2022 au fost înrolați în studiu 99 de pacienți la care s-au detectat fuziuni NRG1, care erau diagnosticați cu diferite tipuri de tumori solide (cancer pulmonar non-microcelular, cancer pancreatic, cancer mamar, colangiocarcinom, cancer colorectal) și care au urmat și alte tratamente anterior (în medie două linii de tratament).
Zenocutuzumab demonstrează eficacitate durabilă, independent de histologia tumorală. La 70% din cazuri s-a observat reducerea dimensiunilor tumorale. Durata mediană a răspunsului a fost de 9,1 luni iar la 25% dintre cei care au răspuns, rezultatele s-au menținut timp de 12 luni. Profilul de siguranță este foarte bun, mai ales prin comparație cu chimioterapia standard, cele mai multe reacții adverse fiind de gras 1-2
Cele mai frecvente localizări tumorale incluse în studiu au fost cancerul pancreatic și cancerul pulmonar non-microcelular. 19 dintre pacienții tratați în studiu erau diagnosticați cu cancer pancreatic, dintre care 42% au atins un răspuns obiectiv. Deși este un tip de neoplasm cu opțiuni terapeutice limitate și o rată de supraviețuire extrem de redusă, mai multe tipuri de terapii inovatoare introduse în ultimii ani demonstrează schimbări importante în managementul terapeutic. De exemplu, deja anumite categorii de pacienți cu cancer pancreatic pot beneficia de terapii aprobate pentru indicații tumor agnostic (pembrolizumab, larotrectinib în cancerele care prezintă fuziuni NTRK).
Validarea biomarkerul NRG1 și extinderea indicațiilor tissue-agnostic
Gena NRG1 codifică neuregulina 1, o moleculă de adeziune celulară, care se leagă de receptorii din familia HER/ERBB, determinând activarea acestora. NRG1 poate fuziona cu mai multe tipuri de receptori, ceea ce creează o structură hibridă care se fixează de membrana celulară externă, unde se leagă preferențial de HER3, care ulterior se cuplează la HER2 și determină semnalizarea celulară implicată în carcinogeneză.
Zenocutuzumab este un anticorp bispecific care conține două fragmente de anticorpi care recunosc simultan HER2 și HER3. Acesta se fixează pe HER2, apoi blochează locul de legare pentru NRG1 de la nivelul HER3 (mecanism numit „dock and block”). Astfel, fuziunile NRG1 nu mai pot activa HER3 și nu mai activează cascada de semnalizare celulară ce determină transformarea malignă:
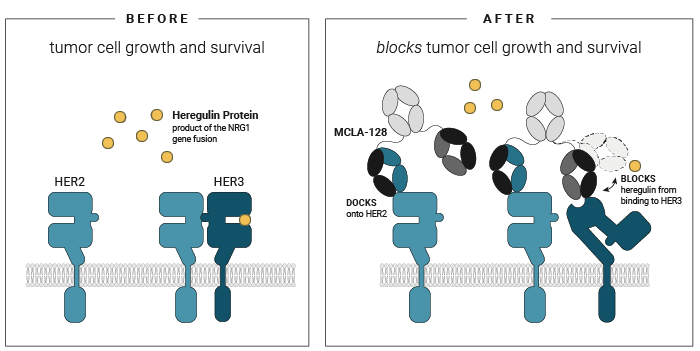
Una dintre cele mai cunoscute abordări în imuno-oncologie este utilizarea anticorpilor monoclonali, însă în ultimii ani, datorită progreselor biotehnologiei, categoriile de anticorpi care pot fi folosite ca agenți terapeutici s-au extins. Anticorpii „clasici” au două brațe cu care se leagă de un antigen, în timp ce anticorpii bispecifici sunt proteine artificiale alcătuite dintr-un braț care se leagă de celula imună (limfocitul T) și cu alt braț se leagă de o proteină de la suprafața celulei canceroase, funcționând ca o punte între cele două. Astfel, celula imună este activată să poată ataca celula transformată malign.
Se estimează că aproximativ 0.5-1.5% din cazurile de cancer pancreatic și 0,3 – 3% din cazurile de cancer pulmonar prezintă fuziuni NRG1, aceste date sunt obținute prin studii epidemiologice și metode de secvențiere care nu mai sunt de actualitate. Conform autorilor, cifrele reale ar putea fi mai mari.
Secvențierea ARN reprezintă metoda optimă pentru detectarea acestor fuziuni rare. Testarea prin imunohistochimie ar putea fi folosită ca o metodă inițială de screening pentru a detecta tumorile solide NRG1 pozitive. De asemenea, identificarea tipului histologic și modificările genetice simultane (ex. statusul KRAS) ar putea facilita triajul inițial al pacienților.
Extinderea utilizării terapiilor pentru indicații independente de localizarea tumorală (tumor agnostic) au marchează o nouă etapă în oncologie, în care testarea biomarkerilor devine esențială, pentru stabilirea diagnosticului de precizie. Acestea impun regândirea modului în care este abordat cancerul și sunt un pas important pentru atingerea potențialului medicinei personalizate.
Centrul pentru Inovație în Medicină a lansat în 2021 un document de poziție asupra Implementării testării NTRK în sistemul de sănătate din România, care ar putea reprezenta un model pentru medicina personalizată.
Citește și
- #ASCO22. Vaccinul terapeutic personalizat, bazat pe ARNm, determină remisiunea la jumătate din cazurile de cancer pancreatic, într-un studiu de fază I
- #ASCO22. Importanța biomarkerilor în selectarea pacienților cu cancer de colon și cancer mamar, în stadii incipiente, care pot evita chimio/radioterapia

