Pembrolizumab, aprobat de FDA pentru tratamentul de linia întâi al cancerului colorectal metastatic MSI-H/dMMR
Administrația Alimentelor și Medicamentelor din SUA (FDA) a aprobat prin procedură accelerată pembrolizumab (Keytruda) pentru tratamentul de primă linie al cancerului colorectal metastatic sau nonrezecabil MSI-H/dMMR (instabilitate satelitară înaltă/deficit de mismatch repair).

Această extindere a indicației și la tratamentul de linia întâi era așteptată după prezentarea în cadrul în cadrul Întâlnirii Anuale a Societății Americane de Oncologie Clinică de anul acesta a rezultatelor studiului KEYNOTE-177. Aprobarea a fost acordată la mai puțin de o lună de la depunerea unei aplicații suplimentare de licențiere a biologicelor (Biologics License Application -sBLA), care a fost evaluată în cadrul programului pilot FDA RTOR (Real-Time Oncology Review) și în cadrul proiectului Orbis.
„Cancerul metastatic colorectal este o boală cu prognostic nefavorabil. Terapiile disponibile, de combinații chimioterapice și alte biologice, sunt asociate cu toxicitate substanțială. Posibilitatea de a avea o opțiune non-chimioterapică pentru anumiți pacienți reprezintă o schimbare importantă a paradigmei în tratament”- Dr. Richard Pazdur, directorul Centrului de excelență oncologică al FDA.
Rezultatele studiului KEYNOTE-177
În cadrul studiului de fază III KEYNOTE-177, pembrolizumab a scăzut semnificativ riscul de progresie al bolii sau deces cu 40% față de chimioterapie și a dublat perioada de supraviețuire liberă de boală (de la 8,2 luni la 16,5 luni).
„Această aprobare are potențialul de schimba paradigma de tratament de primă linie a pacienților cu cancer colorectal MSI-H, pe baza rezultatelor importante ale KEYNOTE-177 care au arătat creșterea perioadei de supraviețuire fără progresie a bolii prin monoterapie cu pembrolizumab față de standardul de îngrijire chimioterapic”- Dr. Roy Baynes, vicepreședinte senior Merck Research Laboratories.
La 12 luni, respectiv 24 de luni, supraviețuirea liberă de boală a fost de 55,3%, respectiv 48,3% în grupul de tratament cu pembrolizumab, față de 37,3%, respectiv 18,6% în grupul de tratament chimioterapic.
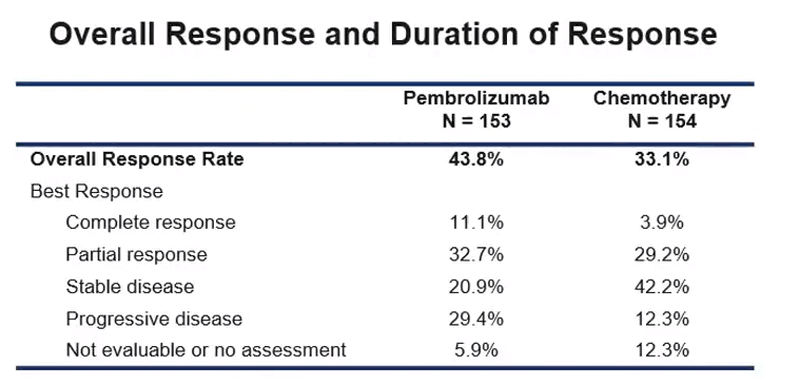
Proporția de pacienți la care s-a observat o scădere a volumului tumoral (rata de răspuns obiectiv) a fost de 43,8% în grupul de tratament cu pembrolizumab față de 33,1% în în grupul de tratament chimioterapic. 11% dintre pacienții care au primit pembrolizumab au răspuns complet (tumoră nedetectabilă), 32,7% au răspuns parțial (scădere a volumului tumoral), iar la 30,9% boala a fost stabilă. În grupul cu chimioterapie răspunsul a fost: 3,9% răspuns complet, 29,2% răspuns parțial, 42,2% boală stabilă. În grupul tratat cu pembrolizumab rata de răspuns total a fost aproape de 3 ori mai mare decât cea din grupul tratat chimioterapic.
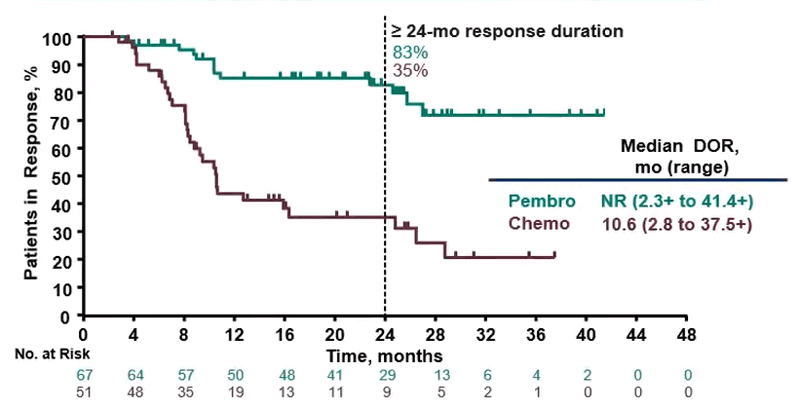
Durata de răspuns a fost mai lungă în grupul tratat cu pembrolizumab: 43% dintre pacienți au avut o durată de răspuns mai lungă de 2 ani, față de 35% dintre pacienții grupului de control.
„Pacienții cu cancer colorectal MSI-H nerezecabil sau metastatic s-au confruntat până acum cu un prognostic nefavorabil, iar toate opțiunile de tratament de linie întâi aprobate FDA erau cele care conțin chimioterapice. Această aprobare oferă o nouă opțiune de de tratament în linia I pentru acești pacienți. În studiul KEYNOTE-177, 43% dintre pacienții care au răspuns la tratamentul cu pembrolizumab au avut o durată de răspuns de cel puțin 2 ani”- Dr. Luis A. Diaz, Șeful diviziei de Oncologie a Tumorilor Solide, Memorial Sloan Kettering Cancer Center.
Cele mai comune reacții adverse din grupul de intervenție (raportate la peste 20% dintre pacienți) au fost: oboseala, durerea musculoscheletală, scăderea apetitului, plutit, diaree, amețeală, rash, febră, tuse, dispnee, constipație, durere și durere abdominală.
Despre studiu KEYNOTE-177
Până la data limită a analizei, studiu de fază III a inclus 307 de pacienți cu cancer metastatic colorectal MSI-H/dMMR. Aceștia au fost împărțiți randomizat în două grupuri de tratament de linie întâi: fie pembrolizumab până la 2 ani, fie unul dintre 6 regimuri de chimioterapie, la alegerea investigatorului. Regimurile de chimioterapie folosite au fost: mFOLFOX6 (5-fluorouracil, leucovorin, oxaliplatin), FOLFIRI (5-fluorouracil, leucovorin, irinotecan), care pot fi utilizate ca atare sau se poate adăuga fie bevacizumab, fie cetuximab.
MSI-H/ dMMR în cancerul colorectal
Aproximativ 5% dintre pacienții cu mCCR au un nivel înalt de mutații, MSI-H. În cazul tumorilor MSI-H/dMMR repararea ADN-ului este afectată, crescând astfel numărul de mutații. Studii anterioare au arătat că la anumiți pacienți, tumorile MSI-H/dMMR sunt asociate cu scăderea supraviețuirii. În plus, pacienții cu tumori metastatice MSI-H/dMMR au o rată mai mică de răspuns la chimioterapie.
Studiile anterioare asupra pacienții cu cancer colorectal metastatic, refractar la chimioterapie, au arătat că pembrolizumab are o rată de răspuns și creștere a supraviețuirii mai bună.
Pembrolizumab este recunoscut ca fiind eficient în cazul mutațiilor MSI-H/dMMR, fiind prima terapie tumor agnostic aprobată de către FDA în 2017. Este un inhibitor PD1 care acționează prin blocarea PD1 localizată pe limfocitul T, permițându-i astfel sistemului imun să acționeze mai eficient pe celulele tumorale.
Citește și:
- #ASCO20. Imunoterapia cu pembrolizumab este eficientă în linia întâi pentru cancerul colorectal metastatic MSI-H/dMMR
- Raport IHE. Progrese în diagnosticul cancerului: cum au schimbat testarea genomică și biomarkerii standardul european?
- #GI20. Studiul TAPUR: terapiile țintite, eficiente în cancerul colorectal avansat, la pacienții care prezintă anomalii moleculare specifice

