Progrese în managementul distrofiei musculare Duchenne: FDA aprobă primul test de screening pentru nou-născuți și o nouă terapie țintită
300 000 persoane suferă în întreaga lume de distrofia musculară Duchenne, o boală fatală cauzată de mutații la nivelul genei distrofinei, cea mai mare din întreg genomul uman. De la observarea primelor semne ale distrofiei musculare Duchenne (DMD) și până la stabilirea diagnosticului pot trece chiar și 2 ani și jumătate. De obicei, pacienții depind de un scaun cu rotile în jurul vârstei de 12 ani și mulți nu supraviețuiesc mai mult de 25 de ani, în funcție de forma bolii. În acest context, eforturile se îndreaptă asupra identificării unor strategi pentru diagnostic precoce și tratamente care să adreseze cauzele bolii.
FDA a aprobat primul test de screening pentru nou născuți, care se poate adăuga panelului standard de screening utilizat în Statele Unite, care include boli precum fibroza chistică sau fenilcetonuria. De asemenea, a fost aprobată prima terapie țintită, cu indicație pentru aproximativ 8% dintre pacienți, care prezintă o mutație specifică la nivelul genei DMD.
Primul test de screening
GSP Neonatal Creatine Kinase-MM kit este primul test de screening aprobat de FDA pentru distrofia musculară Duchenne, dedicat nou-născuților. Acesta permite determinarea valorilor creatinkinazei (CK) din probele prelevate la 24 – 48 de ore de la naștere. Rezultate trebuie să fie confirmate prin alte metode, cum ar fi biopsia musculară sau testarea genetică.

Creatinkinaza este o enzimă exprimată în diferite țesuturi – la nivel cerebral, în mușchi sau cord. Atunci când apare deteriorarea țesutului muscular, forma CK-MM crește în sânge. GSP Neonatal Creatine Kinase-MM măsoară concentrația proteinei CK-MM, din probe prelevate din călcâiul nou-născuților.
„Screeningul nou-născuților permite evitarea lungului drum până la diagnostic și instituirea precoce a tratamentului pentru o boală care altfel ar rămâne timpul de mulți ani nedetectată. Prin determinarea izoformei care se găsește în mușchi și nu a activității totale CK, testul permite identificarea rapidă copiilor care prezintă boala, astfel încât aceștia pot avea șansa la o calitate a vieții mult mai bună” – Linh Hoang, vicepreședinte PerkinElmer
La baza aprobării au stat datele obținute de la peste 3000 de nou născuți, testați pentru valorile proteinelor asociate distrofiei Duchenne și au fost detectate cazurile în care exista mutația care determină apariția bolii. Au fost analizate și 30 de probe de la nou născuți cu boala confirmată, toți fiind identificați corect.
CDC (Centers for Disease Control and Prevention) atenționează asupra necesității diagnosticului precoce pentru stabilirea unei strategii optime de control a bolii.
Distrofia Duchenne, deși o boală rară, reprezintă cel mai frecvent tip de distrofie musculară. Reprezintă o boală ereditară care apare încă din copilărie și se caracterizează prin absența unei proteine esențiale pentru integritatea mușchilor, distrofina. Primele simptome apar între 3 și 5 ani, mai frecvent la băieți. Pe măsură ce boala progresează apar afecțiuni amenințătoare de viață care implică aparatul respirator și cordul.
FDA precizează că acest kit nu este indicat pentru diagnosticul bolii sau pentru screeningul altor forme de distrofii musculare.
Această aprobare permite includerea testării pentru distrofia Duchenne în panelul de evaluări standard pentru nou născuți, în care se regăsesc și afecțiuni precum fenilcetonuria, fibroza chistică și boala cardiacă congenitală. FDA menționează faptul că decizia de screening pentru distrofia Duchenne depinde de fiecare stat.
O nouă terapie țintită
FDA a aprobat prin procedură accelerată și golodirsen, prima terapie țintită indicată pacienților cu distrofie Duchenne care prezintă o mutație în gena distrofinei, la nivelul exonului 53, ce poate fi adresată prin tehnica exon skipping. Aceasta aprobare ar fi indicată pentru aproximativ 8% dintre pacienții cu distrofie Duchenne din SUA.
Distrofina este o proteină care se află toți mușchii scheletici și la nivelul cordului, însă cantități mai mici se găsesc și în celulele nervoase. În mușchi, distrofina face parte dintr-un complex proteic, având rolul de a menține integritatea fibrelor musculare. În timp, lipsa distrofinei conduce la afectarea muchilor scheletici și a fibrelor musculare cardiace.
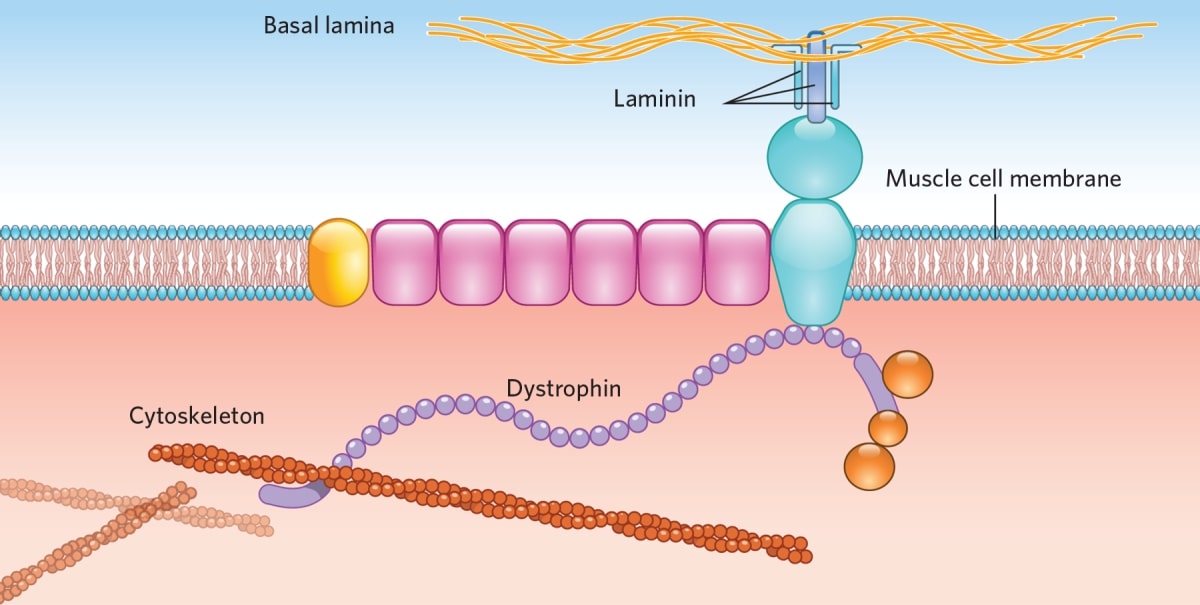
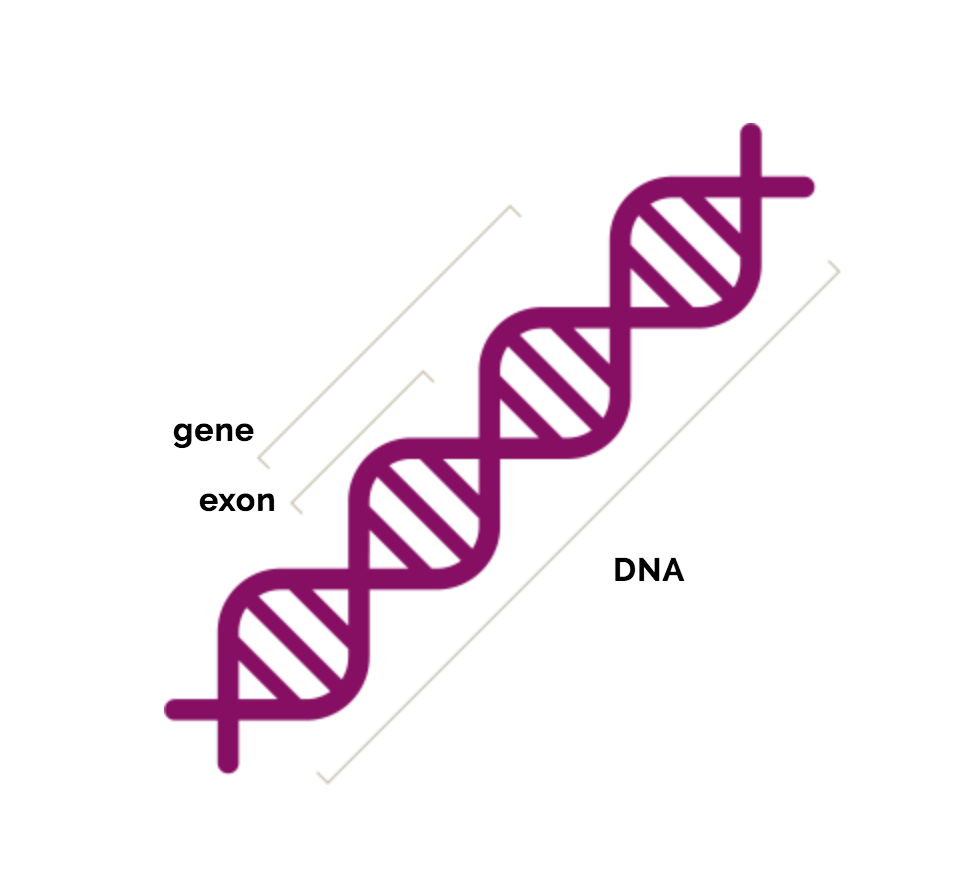
Locusul în care se găsește gena distrofinei are o dimensiune foarte mare, astfel încât la nivelul acestei gene se înregistrează ce mai mare rată de mutații spontane. Gena DMD este alcătuită din 79 de exoni , fiecare conține informația necesară construirii proteinei.
Medicamentele care folosesc tehnologia exon skipping se bazează pe olignonucleotide antisens, molecule care pot modifica expresia genică. Acestea sunt fragmente de acizi nucleici care pot interacționa cu o anumită secvență de la nivelul ADN sau ARN. Tehnica exon skipping permite obținerea unei proteine mai scurte dar funcționale.
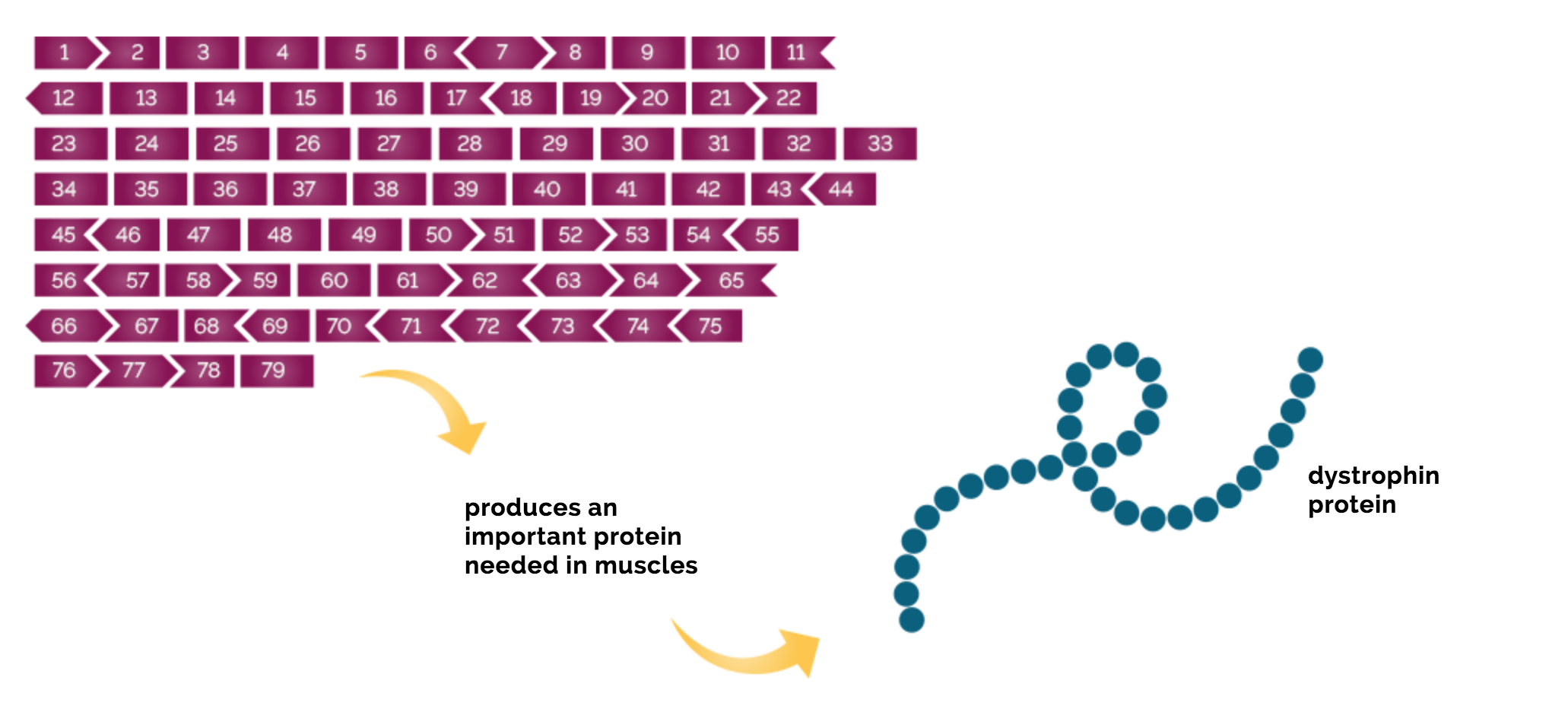
Golodirsen este un nucleotid antisens care se leagă de exonul 53 de la nivelul ARN-ului mesager care corespunde distrofinei ceea ce determină excluderea acestui exon în timpul procesării mesajului din ARN în proteine.
Golodirsen a fost evaluat într-un studiu realizat în două etape. Inițial 12 pacienți cu distrofie Duchenne au fost incluși, dintre care 8 au primit tratamentul iar 4 au primit placebo. În partea a doua a studiului, cei 12 pacienți inițiali au fost evaluați și au fost incluși ulterior și alți 13 pacienți care nu primiseră tratament anterior. Nivelurile distrofinei au crescut de la 0.10% din valoarea normală la 1,02% după 48 de săptămâni de tratament sau mai mult.
FDA a luat în considerare și potențialele riscuri asociate tratamentului. Ca parte din procedura accelerată de aprobare, FDA a solicitat companiei producătoare să realizeze studii care să confirme beneficiile clinice. Studiile aflate în derulare în prezent evaluează eficacitatea tratamentului asupra funcției motorii la pacienții cu o mutație confirmată în gena distrofinei.
În 2016, FDA a aprobat primul tratament țintit pentru distrofia Duchenne, eteplirsen, indicat pentru pacienții cu mutații în gena distrofinei care pot fi tratați prin tehnica exon skipping vizând exonul 51.
Astfel, aproximativ 20% dintre pacienții cu distrofie Duchenne din Statele Unite ale Americii pot beneficia de o opțiune terapeutică odată cu aprobarea celor două medicamente.
Citește și
- FDA a aprobat Zolgensma, prima terapie genică pentru atrofia musculară spinală
- BREAKING NEWS. Luxturna, prima terapie genică aprobată de FDA pentru o boală ereditară care determină orbire

