STUDIU. Cauzele bolilor rare ar putea fi identificate de 3 ori mai rapid prin analiza datelor multiomice și rețelelor moleculare complexe
În ultimele două decenii, dezvoltarea platformelor de secvențiere ADN a permis descoperirea a peste 6.000 de boli rare. Cele mai multe boli rare sunt mongenice, existând o cauză clară la nivelul unei singure gene afectate. Bolile rare reprezintă un model prin care se poate studia bine relația dintre modificarea genetică și consecința fenotipică, comparativ cu bolile multigenice, multifactoriale. Cu toate acestea timpul până la diagnostic rămâne îndelungat și costurile asociate sunt ridicate, astfel încât sunt necesare noi abordări pentru bolile rare rămase necaracterizate până în prezent.
O echipă de la CeMM Research Center for Molecular Medicine din Viena, propune o nouă strategie pentru identificarea cauzelor bolilor rare și scurtarea traseului pacienților. Aceștia au dezvoltat o rețea moleculară complexă ce cuprinde peste 20 milioane de interacțiuni genice alături de analiza proteomică (caracterizarea proteinelor) și analiza comprehensivă a fenotipurilor (eng. phenome, totalitatea trăsăturilor fenotipice ale unui organism). Studierea mecanismelor bolilor rare pe baza analizelor moleculare ce intersectează multiple niveluri de organizare biologică crește probabilitatea de identificare a genelor patologice de cel puțin 3 ori comparativ cu analiza izolată a fiecărui nivel biologic (ex. studierea izolată a genomului). Rezultatele cercetării au fost publicate recent în Nature.
Bolile rare cuprind un spectru larg de afecțiuni care intersectează mai multe specialități. Acestea includ fenotipuri specifice anumitor organe/celule, dar și afecțiuni sindromice (cu impact asupra întregului organism). Bolile rare au fost studiate până acum după paradigma clasică: o genă, o boală, un mecanism, iar înțelegerea actuală asupra modului în care modificările genetice influențează sistemele biologice cuprinse între genotip și fenotip este limitată.
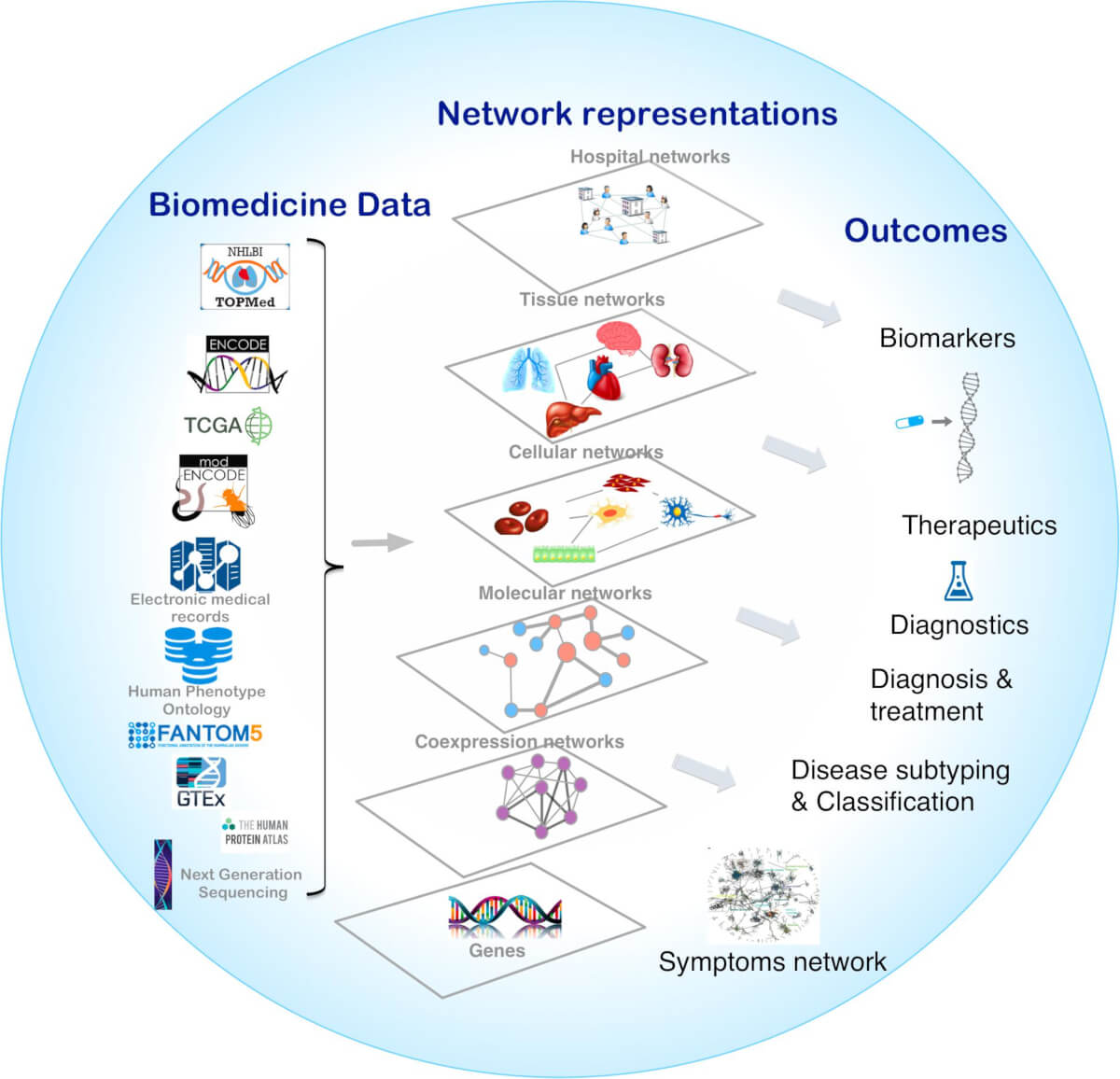
Diferite niveluri de organizare biologică, de la genom, transcriptom (analiza seturilor ARN) și până la fenom sunt influențate în contextul unei boli rare. Toate acestea pot oferi informații importante pentru elucidarea mai rapidă a unei anomalii genice. Pentru maximizarea informației acționabile care poate fi obținută prin analiză multiomică sunt necesare intrumente de analiză avansate. Rețelele moleculare complexe sunt ca niște hărți care permit organizarea acestor date și cercetarea de noi gene cu semnificație patologică, pot oferi informații importante pentru folosirea de medicamente pentru noi indicații, noi combinații terapeutice etc.
Peste 3.700 de boli rare au fost caracterizate folosind o rețea multiplex, ce include 46 de niveluri de organizare (peste 20 de milioane de interacțiuni genice alături de informația despre interacțiunile dintre proteine și caracteristicile fenotipice). Nodurile de rețea sunt reprezentate de gene, iar legăturile indică relațiile în care sunt implicate pe fiecare nivel biologic, de la interacțiunea directă dintre proteinele codificate de acele gene, până la caracterele fenotipice similare. Rețeaua permite astfel cuantificarea impactului bolilor rare pe fiecare nivel de organizare biologică.
Datorită designului modular al rețelei multiplex, este posibilă cuantificarea mecanismelor bolii pe fiecare nivel de organizare biologică (genom, proteom, fenom) și se poate determina dacă anumite celule, țesuturi, organe sunt afectate mai mult sau mai puțin de un defect genetic. Rezultatele studiului arată utilitatea conceptului de „module”, care este folosit deja în studierea bolilor complexe.
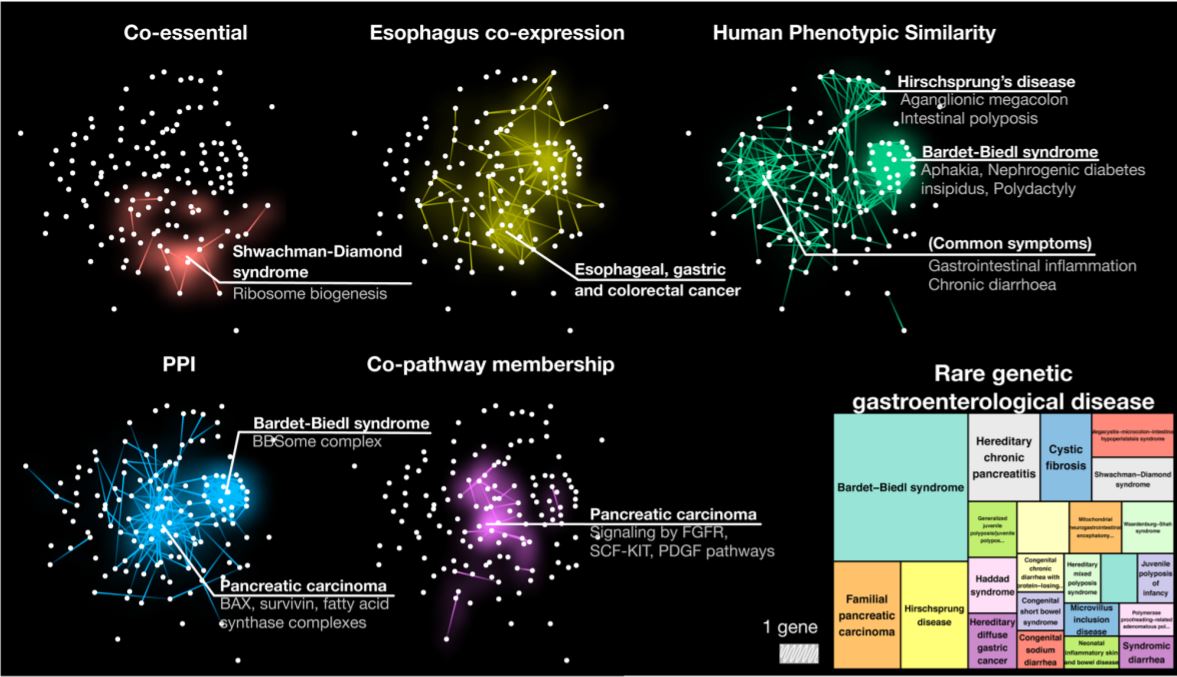
În contextul bolilor complexe, studiile care folosesc analiza de rețea au identificat relații între gene, diferite tipare de interacțiune și manifestări fiziopatologice. S-a observat că genele nu sunt distribuite aleatoriu în rețelele moleculare, ci sunt organizate în module specifice care oferă informații suplimentare despre boală. Și în cazul bolilor rare (majoritatea monogenice), se pot aplica metode de studiu dezvoltate pentru bolile poligenice cum sunt analizele rețelelor moleculare complexe pentru identificarea mai rapidă a cauzei.
Secvențierea genomului conduce la identificarea unor variante rare (frecvența alelelor de sub 1%) în zeci/sute de regiuni codante diferite, ale căror consecințe sunt necunoscute. Aceste variante pot fi filtrate pe baza diferitelor criterii (frecvența în populație, analizele de segregare etc.) pentru a se restrânge numărul de gene candidate. Totuși, identificarea unei singure gene cauzale este o provocare atât pentru practica medicală, dar și în cercetare.
Noul studiul demonstrează că instrumentele folosite în cercetarea rețelelor biologice complexe sunt fezabile și pentru prioritizarea variantelor genomice de la pacienții cu boli rare. Mai mult decât atât, o astfel de analiză comprehensivă poate explica și fenotipurile diverse care se observă la pacienții cu boli rare și caracterul sindromic al acestor afecțiuni.
Citește și:
- Genomics England va lansa un program pilot pentru secvențierea întregului genom (WGS) de la 200 de mii de nou-născuți. Câte boli rare ar putea fi depistate și tratate astfel?
- PREMIERĂ. Secvențierea întregului genom, validată ca test de primă linie pentru diagnosticul bolilor rare în UK. Care sunt beneficiile pentru pacienți și pentru sistemul de sănătate?

