STUDIU. Noi subtipuri ale mielomului multiplu, identificate prin analiză multiomică. Rezultatele ar putea schimba sistemele internaționale de clasificare
Mielomul multiplu este un tip de cancer hematologic în care se observă o mare heterogenitate clinică și moleculară. Deși pacienții răspund inițial la terapia standard, majoritatea înregistrează recăderi și trebuie să urmeze linii multiple de tratament. Aproximativ 15% din cazuri fac parte din categoria de risc înalt și au o recădere în primii 2 ani de la diagnostic. Studiile din ultimii ani au demonstrat utilitatea secvențierii de nouă generație în identificarea unor mecanisme de rezistență primară sau secundară, precum și noi ținte terapeutice. Cu toate acestea, acumularea de date moleculare complexe aduce provocări legate de interpretarea semnificației acestora și maximizarea beneficiului clinic pentru pacienți.
O echipă de la Universitatea de Medicină Mount Sinai propune o nouă metodă de clasificare a mielomului multiplu (MM), pe baza algoritmului MM-PSN (Multiple Myeloma Patient Similarity Network), care integrează seturi de date complexe provenite din analiza genomică și transcriptomică. Datele au fost prelucrate cu ajutorul unui sistem computerizat care a identificat 12 subgrupuri ale bolii, caracterizate de profiluri de risc diferite și pentru care pot fi identificate terapii specifice. Rezultatele, publicate în Science Advances, ar putea schimba sistemele internaționale de clasificare pentru MM.
Caracterizarea funcțională a subgrupurilor în cadrul rețelei MM-PSN oferă informații cu implicații imediate pentru alegerea terapiei și derularea studiilor clinice. Fiecare subgrup ar putea răspunde diferit la terapii țintite și la imunoterapii. De exemplu, au fost definite grupurile de pacienți care nu răspund la terapia CAR-T anti-BCMA sau pacienții care au cel mai bun răspuns la terapia țintită cu venetoclax.
Modelul MM-PSN a rafinat cunoștințele anterioare despre markerii moleculari în MM și demonstrează avantajele integrării mai multor tipuri de date pentru stabilirea riscului pacienților. Până acum nu a mai existat o clasificare a bolii care să includă simultan analiza genomică și transcriptomică.

Împărțirea pacienților în subgrupuri omogene pe baza informațiilor biologice, clinice, legate de răspunsul la tratament sunt abordări care definesc medicina de precizie. Datorită evoluției tehnologiilor care permit o analiză detaliată a proceselor biologice (ex. secvențiere genomică, analiza expresiei genelor, analiza seturilor de proteine), noi niveluri de informație se pot adăuga pentru caracterizarea fiecărei persoane. Atingerea obiectivului de a „alege tratamentul potrivit/intervenția potrivă pentru pacientul potrivit” necesită integrarea tuturor tipurilor de date care pot fi generate.
PSN (patient similarity network) definește o dimensiune a medicinei de precizie prin care pacienții sunt grupați în funcție de trăsături similare pe baza unor seturi complexe de date. Acesta este un concept ce ține de medicina bazată pe rețele biologice.
În modelul PSN folosit pentru acest studiu, pacienții sunt reprezentați ca nodurile rețelei și sunt conectați unul cu altul în funcție de caracteristici similare ale profilului genomic și transcriptomic. Astfel, pot fi identificate categorii de pacienți care împărtășesc date moleculare similare și realizată o stratificare de mare acuratețe a cazurilor. Instrumente similare au permis caracterizarea complexității moleculare și pentru alte tipuri de neoplasme (cancer colorectal, pancreatic, glioblastom).
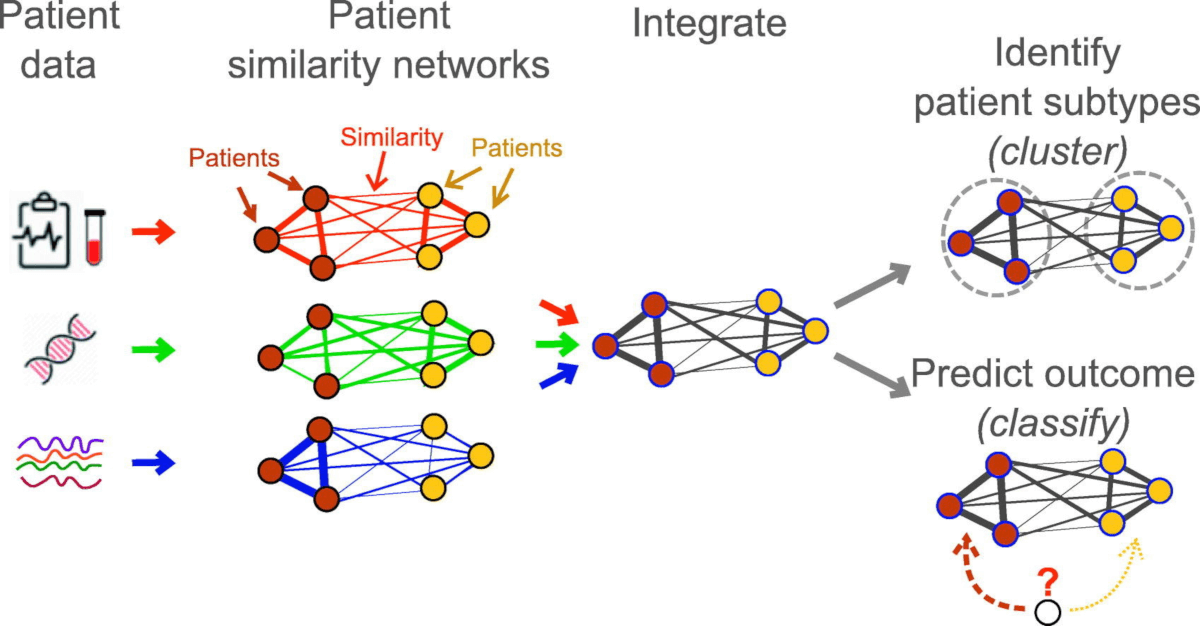
Pentru crearea modelului MM-PSN au fost analizate 5 tipuri de date obținute de la 655 de cazuri nou-diagnosticate cu mielom multiplu, din cadrul studiului MMRF CoMMpass. Datele au fost obținute prin secvențierea ARN, secvențierea exomului (WES) și secvențierea întregului genom (WGS).
Au fost definite 3 grupuri principale și 12 subgrupuri cu trăsături genetice și moleculare distincte. Studiile clasice s-au concentrat până acum pe rolul unor modificări genetice izolate care ar putea avea implicații prognostice, însă cercetarea actuală vizează înțelegerea heterogenității inter-tumorale a MM și studierea impactului simultan al mai multor modificări genetice și moleculare.
- Grupul 1 (alcătuit din 4 subgrupuri ) cuprinde cazurile de mielom hiperdiploid (în care există copii suplimentare ale anumitor cromozomi/fragmente de cromozomi). Aceste tipuri sunt caracterizate printr-un profil inflamator mai accentuat și prezintă căi de evitare a răspunsului imun.
- Grupul 2 (5 subgrupuri) include pacienți cu translocații MMSET/MAF, care prezintă neoplasme cu evoluție rapidă.
- Grupul 3 (3 subgrupuri) include cazuri cu supraexpresie MDM2, ce determină inhibarea activității Tp53 (o genă supresoare tumorală). În aceste cazuri se întâlnesc mai frecvent macroglobulinemia Waldenström și amiloidoza.

Una dintre cele mai importante descoperiri este o anomalie ce implică brațul lung al cromozomului 1 (+1q), identificată la aproximativ 40% din cazurile de MM, dar și în alte tipuri de cancere (cancer de sân, cancer hepatocelular, neoplasme mieloproliferative). Pacienții cu gamapatii monoclonale de semnificație nedeterminată (un precursor al MM) care prezintă markerul +1q au un risc mai mare de progresie către MM (un timp median până la progresie de 2 ani).
MM-PSN a caracterizat 6 subgrupuri (1c, 2b, 2c, 2d, 2e și 3c) cu expresie +1q, toate asociate cu alte leziuni recurente și având cel mai scurt timp până la recădere și cea mai mare mortalitate, comparativ cu celelalte subgrupuri.
Deși impactul +1q a fost descris și în cercetări anterioare, analiza comprehensivă realizată în acest studiu arată mult mai clar semnificația acestei anomalii cromozomiale, care ar trebui să devină un factor central în evaluarea riscului pentru pacienții cu MM netratați anterior. Subgrupul de pacienți cu cel mai slab prognostic, atât în ceea ce privește supraviețuirea fără progresia bolii, cât și supraviețuirea globală, au prezentat +1q alături de translocația t(4;14) ce implică gena MMSET.
Prezența +1q determină un prognostic nefavorabil chiar și pacienților considerați până acum la a avea un prognostic mai bun, cum sunt cei care prezintă MM hiperdiploid (HD, care prezintă un număr mai mare de cromozomi decât ar fi normal). În schimb, pacienții cu +15q prezintă rate mai ridicate ale supraviețuirii generale și supraviețuirii fără progresia bolii (ex. subgrupul 2d, caracterizat prin translocație MMSET, +1q și +15q).
În cadrul studiului sunt detaliate și implicațiile terapeutice ale noului sistem de clasificare. De exemplu, supraexpresia genelor tCCND1 și BCL2 reprezintă markeri de sensibilitate la terapia țintită cu venetoclax, în timp ce activarea genei MCL1 este asociată cu mecanisme de rezistență. Subgrupul 3b a prezentat o sensibilitate crescută la venetoclax , în timp ce pacienții din subgrupul 2b erau rezistenți.
De asemenea, subgrupul 3a e caracterizat prin supraxpresia FLT3, o mutație acționabilă prin inhibitori FLT3 care sunt folosiți în leucemia acută mieloidă.
Pacienții din subgrupurile 1b și 1c, care prezintă o activare căii de semnalizare MET pot fi tratați cu inhibitori MET cu succes. În schimb, pacienții din subgrupul 1d prezintă modificări ce determină expresie mai scăzută a markerului BCMA, care este o țintă a terapiilor CAR-T. În acest caz, administrarea unei terapii celulare anti-BCMA ar putea conduce la un eșec terapeutic.
Studiul confirmă avantajele unei analize multiomice pentru înțelegerea heterogenității MM și eficacitatea PSN de a organiza seturi de date complexe pentru a genera modele de boală. Sistemul de clasificare MM-PSN este o resursă importantă care poate optimiza managementul pacienților cu MM. Parametrii folosiți în studiu, care definesc riscul înalt, pot fi evaluați ușor în practica medicală, prin metode accesibile (FISH, analiză citogenetică).
Citește și:
- FDA aprobă prima terapie celulară anti-BCMA pentru pacienții cu mielom multiplu recidivat și refractar la cel puțin patru terapii anterioare
- STUDIU. Testarea genetică pentru pacienții cu mielom multiplu permite selecția cazurilor la risc înalt, care nu răspund la tratamentul standard

