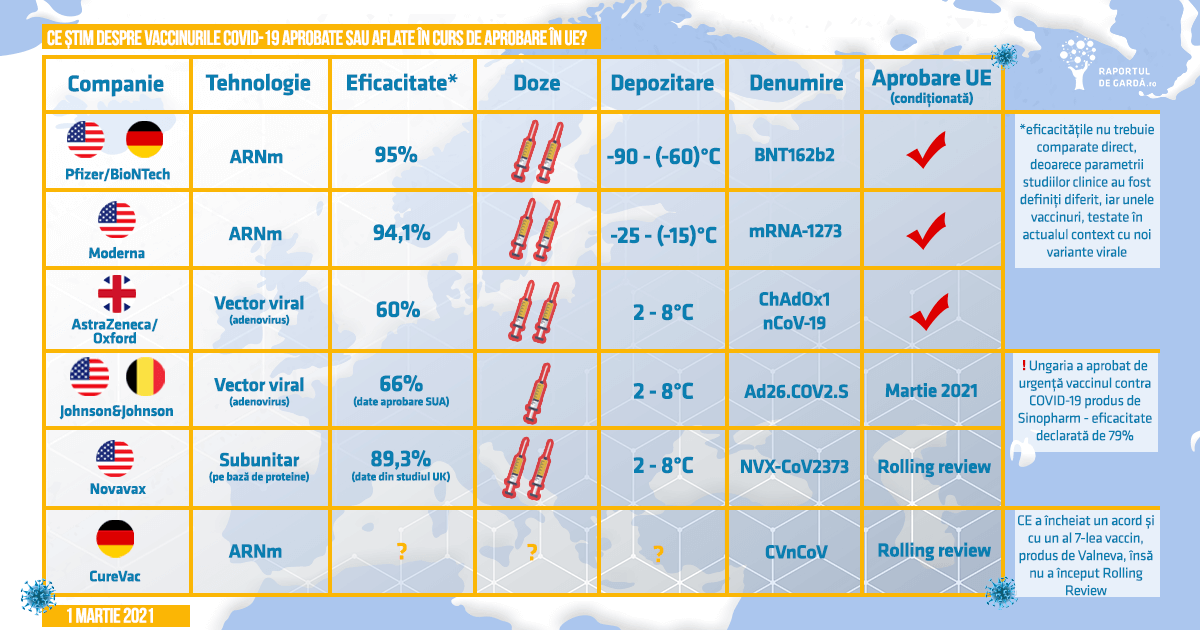
Vaccinul Janssen împotriva COVID-19 a fost autorizat pentru utilizare condiționată în UE
Pe 16 februarie 2021, EMA a primit cererea de autorizare condiționată de introducere pe piață (CMA) pentru vaccinul COVID-19 dezvoltat de Janssen-Cilag International N.V. (parte a companiilor farmaceutice Johnson&Johnson). În Statele Unite, vaccinul a fost aprobat pe 28 februarie 2021.
Astăzi, 11 martie 2021, la împlinirea unui an de la declararea de către Organizația Mondială a Sănătății a pandemiei COVID-19, vaccinul Janssen a primit autorizația condiționată de punere pe piață din partea Comisiei Europene, pentru prevenirea COVID-19 la persoanele în vârstă de 18 ani și peste. Este al 4-lea vaccin aprobat la nivelul UE și primul care este recomandat pentru administrare în doză unică.
Un pas premergător aprobării oficiale acordată de către CE este evaluarea vaccinului de către Agenția Europeană a Medicamentului. Comitetul pentru produse medicale de uz uman (CHMP) din cadrul EMA a concluzionat prin consens că datele privind vaccinul sunt robuste și îndeplinesc criteriile de eficacitate, siguranță și calitate.

Datele care au condus la aprobare
Studiile clinice au inclus peste 44.000 de persoane din Statele Unite, Africa de Sud și țări din America Latină. Jumătate au primit o singură doză de vaccin și jumătate au primit placebo.
S-a constatat o reducere cu 67% a numărului de cazuri simptomatice de COVID-19 după 2 săptămâni la persoanele care au primit vaccinul COVID-19 Janssen (116 cazuri din 19.630 de persoane) comparativ cu persoanele cărora li s-a administrat placebo (348 din 19.691 de persoane). Aceasta înseamnă că vaccinul a avut o eficacitate generală de 67%.
Efectele secundare ale vaccinului COVID-19 Janssen din studiu au fost de obicei ușoare sau moderate și au dispărut în câteva zile după vaccinare. Cele mai frecvente au fost durerea la locul injectării, cefaleea, oboseala, durerea musculară și greața.
Cum funcționează vaccinul Janssen
Ad26.COV2.S folosește un vector viral recombinant (Ad26), care exprimă proteina S a SARS-CoV-2 într-o formă stabilizată, în mod asemănător cu vaccinul produs de AstraZeneca (aprobat în UE) – vectorul viral va livra gena care codifică proteina spike în celulele umane. S-a utilizat un tip de adenovirus care determină infecții respiratorii ușoare la om pentru realizarea vaccinului. Acest adenovirus este modificat pentru a nu se putea replica și pentru a transporta gena de interes sub forma unui fragment de ADN în organismul uman.
Ce urmează?
Comisia Europeană a aprobat contractul cu Janssen pe data de 8 octombrie 2020. Odată cu obținerea autorizației condiționate de introducere pe piață, Janssen va putea livra 200 de milioane de doze din vaccinul COVID-19 către UE, începând cu al doilea trimestru al anului 2021. Contractul permite statelor membre să cumpere încă 200 de milioane de doze. Acest lucru se va adăuga la totalul de 600 de vaccinuri furnizate de către BioNTech/Pfizer, la cele 460 de milioane de doze de vaccin ale Moderna, precum și la cele 400 de milioane de la AstraZeneca.
Aprobarea vaccinului Janssen în SUA, comentată de Dr. Marius Geantă, președinte Centrul pentru Inovație în Medicină:
Citește și:
- Vaccinul AstraZeneca contra COVID-19 a primit autorizație condiționată de punere pe piață în UE
- Esențial COVID-19: Autorizarea condiționată a vaccinului Pfizer/BioNTech în UE și poziția ESMO cu privire la vaccinarea pacienților oncologici
- CONCLUZII. Consultarea publică pentru vaccinul anti-COVID19, organizată de Agenția Europeană a Medicamentului

