#BiotechWeek2020. Terapiile genice: cum a evoluat domeniul și care sunt cele mai importante lecții în ultimii 30 de ani?
De peste 50 de ani este explorată ideea de a se dezvolta un tratament curativ prin introducerea unei gene funcționale în celulele umane, însă abia în ultimii 2-3 ani terapiile genice au început să fie aprobate într-un ritm accelerat.
Se estimează că cel puțin 3 terapii genice și celulare vor fi aprobate în 2020, iar în următorii 5 ani se preconizează între 10 și 20 de terapii genice aprobate anual. Până în 2030 ar putea fi aprobate între 30 și 60 de terapii genice și celulare pe an. În 2019 erau peste 1.000 de studii clinice în dezvoltare. Există o creștere cu 25% a numărului de terapii genice candidate în studii de fază I-III, înregistrată în perioada 2019-2020. Dacă se adaugă cercetările preclinice, procentul se dublează.
Ascultați al treilea episod – terapiile genice, al podcastului RaportuldeGardă.ro, o ediție specială, realizată în colaborare cu Centrul pentru Inovație în Medicină:
Conform FDA, terapia genică are ca scop modificarea expresiei unei gene sau influențarea proprietăților biologice ale celulelor cu scopul de a trata sau a vindeca o boală. În termenul de terapie genică sunt cuprinse mai multe tipuri de intervenție asupra genomului uman. Aceasta fie presupune înlocuirea unei gene patologice cu o copie normală a genei respective, fie înseamnă inactivarea unei gene care nu funcționează corect.
Terapiile genice sunt diferite de alte tratamente care există pe piață din mai multe perspective.
- Promisiunea vindecării este unul dintre elementele care diferențiază terapiile genice de tratamentele clasice;
- Spre deosebire de moleculele mici sau de proteine ( Ex. anticorpi monoclonali), aceasta se administrează o singură dată, într-o doză unică. Nu reprezintă un tratament care se administrează cu o anumită frecvență și poate fi întrerupt;
- Cele mai multe terapii genice în dezvoltare se adresează mai ales bolilor rare sau bolilor foarte grave pentru care nu există opțiuni terapeutice curative;
- Terapiile genice reprezintă unele dintre cele mai scumpe tratamente de pe piață. Creșterea numărului de terapii aprobate în ultimii ani impune o regândire a căilor de acces la nivelul sistemelor de sănătate.
Cum au evoluat terapiile genice?
Ideea de a transfera material genetic în celulele prelevate de la mamifere apare publicată pentru prima dată în 1972. Cu toate acestea, dezvoltarea cercetărilor în domeniul terapiilor genice a depins de progresele înregistrate în biotehnologie. Pe de o parte, identificarea și clonarea genelor relevante pentru patologia umană a fost posibilă prin noile instrumente facilitate de evoluția biologiei moleculare și descoperirea tehnologiei ADN-ului recombinant. Gena pentru beta globină a fost prima clonată. Pe de altă parte, au apărut primele strategii eficiente pentru transferul genei în organism – vectori virali.
Anii ‘90: primele terapii genice administrate cu succes la om
Numeroase studii pentru evaluarea terapiilor genice au fost dezvoltate în 1990, după succesul tratării primului caz pediatric pentru o boală ereditară – sindromul imunodeficienței primare combinate. Până în 2000, terapiile genice au fost evaluate pentru aproape 3.000 de pacienți, în 400 de studii. La finalul anilor 2000 apare primul deces într-un studiu clinic, ceea ce atrage o etapă de schimbări în domeniu. Următorul deceniu a reprezentat perioadă de adaptare și asimilare a lecțiilor dobândite până atunci: reglementarea riguroasă a producerii terapiilor genice, îmbunătățirea tehnologiei, a vectorilor utilizați.
În SUA, primele terapii genice au fost aprobate abia în 2017. Din acel moment, ritmul este accelerat, dar și provocările în ceea ce privește accesul la aceste terapii sunt semnificative.
În 2017 începe era modernă în dezvoltarea terapiilor genice
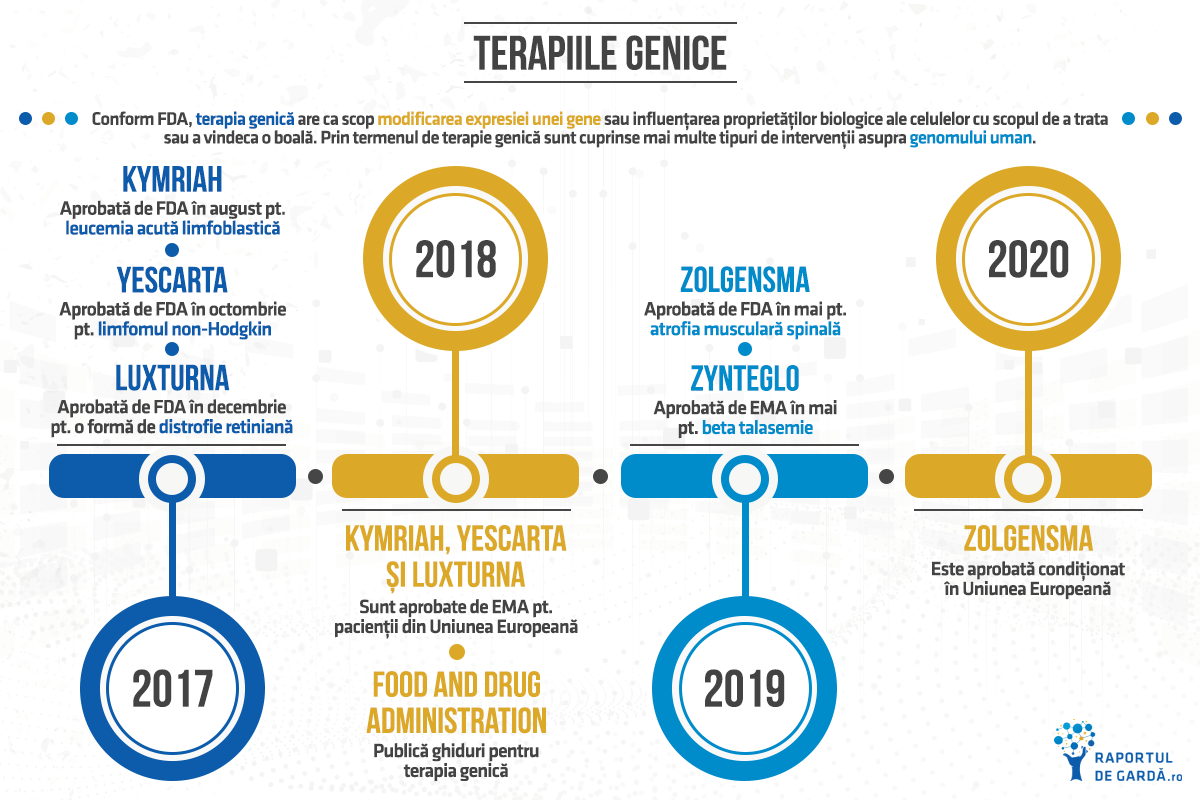
Luxturna, pentru tratamentul amaurozei congenitale Leber, a devenit în decembrie 2017 prima terapie genică aprobată vreodată în SUA. În 2018 primește aprobare și din partea Agenției Europene a Medicamentului (EMA), fiind prima terapie curativă pentru o boală ereditară aprobată în UE. Luxturna se administrează o singură dată la nivelul retinei, transferând o versiune sănătoasă a genei responsabile de această boală (RPE65), prin intermediul unui vector viral.
În aceeași perioadă (2017-2018), Kymriah și Yescarta primesc aprobare în SUA și UE pentru tratamentul anumitor tipuri de cancere hematologice pentru care opțiunile terapeutice erau limitate.
În mai 2019, FDA a aprobat Zolgensma, prima terapia genică pentru copiii cu atrofie musculară spinală (AMS), cu vârste sub 2 ani. După Luxturna, aceasta este a doua terapie genică aprobată pentru o boală ereditară în Statele Unite.
Prima terapie genică pentru pacienții cu beta-talasemie a primit recomandare de aprobare în Uniunea Europeană în 2019, la sfârșitul lunii martie. Zynteglo se administrează o singură dată în viață și presupune introducerea unor copii funcționale ale genei de beta globină în celulele stem hematopoietice recoltate de la pacient. Zynteglo este destinată pacienților cu forme grave de beta talasemie, care impun dependența de transfuzii de sânge pe termen lung.
Tipuri de terapii genice
Cel mai frecvent, terapia genică funcționează prin introducerea unei copii normale a unei gene afectate în celulele pacientului. Acestea sunt numite și terapii de adiție genică. Gena este obținută în laborator și introdusă într-un vector care o transportă în nucleu, unde poate rămâne sau se poate integra în genom.
Vectorul poate fi viral sau non-viral. În cazul primei categorii, virusului îi lipsește ADN-ul viral, sunt practic nanoparticule bazate pe proteine care traversează celula și livrează gena de interes în nucleu. Majoritatea terapiilor aflate în dezvoltare folosesc capside bazate pe virusuri adeno-asociate (AAV – adeno associated virus). Acestea prezintă o serie de avantaje precum:
- Capacitate de a infecta o gamă largă de celule;
- Profil de siguranță bun;
- Răspuns imun ușor;
- Nu depind de celulele aflate în diviziune;
- Nu se integrează în genomul gazdei, risc scăzut de mutageneză inserțională;
- Se pierde în celulele care se divid.
În funcție de tipul celulelor care sunt modificate, terapia genică pot fi:
- Somatică – influențează doar persoana respectivă și dispare odată cu organismul. Există deja terapii aprobate și numeroase în cercetare;
- Germinală (se folosesc ovule, spermatozoizi sau embrioni) – se transmite în mai multe generații. Nu există terapii aprobate. Barierele etice reprezintă încă o provocare importantă.
După modul în care se administrează terapia, acestea pot fi:
- Ex vivo
Modificările genetice se realizează în afara organismului, asupra celulelor prelevate de la pacient. De exemplu, terapiile CAR-T, deși sunt cunoscute cel mai des sub denumirea de terapii celulare, ele sunt de fapt un tip de terapie genică ex vivo. Celulele T ale pacientului sunt modificate cu ajutorul unui vector viral și readministrate pacientului.
- In vivo
Terapiile in vivo presupun administrarea materialului genetic de interes direct pacientului. De exemplu, Luxturna, o terapie genică aprobată pentru o formă de distrofie retiniană care se administrează direct la nivelul țesutului ocular.
Provocări în dezvoltarea terapiilor genice
- Costurile ridicate
Modelul clasic de rambursare, prin care tratamentele sunt plătite pe măsură ce sunt administrate, nu va mai funcționa. Modelul trebuie să se adapteze pentru tratamente administrate chiar și o singură dată, însă cu beneficii pentru toată viața. Odată ce un grup de pacienți a primit acest tip de tratament, piața poate scădea considerabil.
Luxturna, prima terapie genică aprobată în SUA, a ajuns pe piață cu un preț de aproximativ 1 milion de dolari. În mai 2019, Zolgensma a fost aprobată de FDA pentru tratamentul pacienților pediatrici cu vârste mai mici de 2 ani, cu mutații bialelice ale genei SMN1, devenind cel mai scump tratament din lume, estimat la un preț de 2,1 milioane de dolari pentru un pacient.
Au fost propuse mai multe metode de plată pentru astfel de tratamente. Contractele bazate pe rezultate sunt o opțiune, în cadrul cărora producătorii sunt rambursați doar dacă tratamentul atinge anumite obiective clinice prestabilite. O altă variantă este plata în „rate” de-a lungul unei anumite perioade (anuități), în care se pot include și contracte bazate pe rezultate
- Demonstrarea efectului în timp
Hemofilia a reprezentat una dintre cele mai importante candidate pentru terapia genică. Anul acesta au fost publicate date dintr-un studiu care a inclus cea mai lungă perioadă de urmărire pentru o terapie genică pentru hemofilia A. Date la 4 ani au fost prezentate in luna iunie și arătau o reducere medie cu 96% a utilizării factorului VIII, reducere de peste 90% a episoadelor de sângerare cu o singură administrare a terapiei. Terapia genică ar putea înlocui cele 100 – 150 de injecții pe care un pacient trebuie să le primească în fiecare an și ar putea reduce sângerările articulare.
Cu toate acestea, deși aprobarea era așteptată pentru luna august, FDA a decis că au nevoie de mai multe date, specificând importanța unei perioade adiționale de follow-up de încă doi ani.
- Răspunsul imun față de vectorul utilizat
Prevalența anticorpilor neutralizanți împotriva anumitor subtipuri ale virusului ajunge până la 70% în populația generală. Mai mult decât atât, organismul poate dezvolta anticorpi pentru a neutraliza vectorii folosiți. Aceste categorii de pacienți nu sunt incluse în studiile care evaluează terapii genice. Organismul dezvoltă, însă, răspunsuri imune împotriva AAV și acesta este un motiv pentru scăderea eficienței terapiei.
Pe de o parte, pot exista anticorpi preexistenți împotriva proteinelor din capsidă, ceea ce limitează transducția – prezența de anticorpi neutralizanți preexistenți blochează transducția în momentul administrării intravasculare. Pe de altă parte, pot apărea răspunsuri imune celulare întârziate și acestea au ca țintă celulele în care s-a realizat transducția, ceea ce poate scădea expresia factorului.
Potențiale strategii în aceste cazuri includ plasmafereza, imunosupresia, folosirea de serotipuri cu prevalență mai mică, administrare localizată.
- Traseul pacientului
Primele terapii genice sunt orientate spre boli rare, astfel încât identificarea pacienților eligibili este o sarcină dificilă. De asemenea, terapiile genice au fost cercetate pentru boli care sunt relativ ușor de țintit.
Citește și:
- ÎNREGISTREAZĂ-TE. Conferința de Medicină Personalizată 2020, în contextul Săptămânii Europene a Biotehnologiei
- #BiotechWeek2020. Medicamentele biologice: ultimele dezvoltări în domeniu și cele mai recente aprobări
- #BiotechWeek2020. Cum a evoluat domeniul genomicii și care sunt aplicațiile în practica medicală?


