Zolgensma, prima terapie genică pentru atrofia musculară spinală, primește aprobare condiționată în UE
Comisia Europeană a emis aprobarea condiționată pentru Zolgensma (onasemnogene abeparvovec), prima terapie genică pentru tratamentul atrofiei musculare spinale (AMS). Zolgensma este indicată pacienților cu mutație bialelică la nivelul genei SMN1 și cu diagnostic clinic de AMS de tip 1 sau până la 3 copii ale genei SMN2. Aprobarea include pacienți pediatrici care au până la 21 de kilograme.
Compania producătoare, AveXis (care din 2018 face parte din grupul Novartis) a activat, odată cu aprobarea în UE, programul „Day One”, care stabilește un sistem de plată care să permită accesul timpuriu al pacienților la tratament și să se adapteze ulterior mecanismelor de rambursare specifice fiecărei țări.
În mai 2019, Zolgensma a fost aprobată de FDA pentru tratamentul pacienților pediatrici cu vârste mai mici de 2 ani, cu mutații bialelice ale genei SMN1, devenind cel mai scump tratament din lume, estimat la un preț de 2,1 milioane de dolari pentru un pacient. În martie, tratamentul a fost aprobat și în Japonia, la un preț de 1,5 milioane de dolari.
Prin programul „Day One” se instituie un cadru care asigură faptul că toate cheltuielile inițiale necesare pentru tratamentul pacienților, chiar înainte de stabilirea sistemelor naționale de plată și rambursare, se aliniază cu prețurile negociate în urma analizelor clinice și economice, prețuri care vor reflecta valoarea adusă de terapia genică.
În Franța, pacienții pot avea deja acces rapid la Zolgensma și urmează ca terapia să fie disponibilă în curând și pacienților din Germania.
„Chiar și în condițiile pandemiei, nevoia de tratament pentru AMS a determinat crearea căilor de acces în Franța și Germania pentru Zolgensma, un tratament cu potențial curativ administrat într-o doză unică. În plus, ne-am întâlnit cu peste 100 de organizații din Europa pentru a discuta despre planul Day One, cu scopul de a asigura accesul rapid, prin opțiuni care permit adaptarea la mecanismele de stabilire a prețului și rambursare specifice fiecărei zone” – Dave Lennon, președinte AveXis
Comitetul pentru medicamente de uz uman (CMPH) din cadrul Agenţiei Europene a Medicamentului (EMA) a recomandat autorizarea de punere pe piaţă condiționată a Zolgensma în luna martie.
550-600 de copii se nasc în Europa în fiecare an cu atrofie musculară spinală, o boală neuromusculară rară cauzată de anormalii la nivelul genelor SMN (survival motor neuron), ceea ce conduce la pierderea rapidă a neuronilor motori. Este principala cauză de mortalitate pediatrică printr-o boală genetică. Pierderea neuronilor motori este ireversibilă și sunt afectate multiple funcții motorii esențiale precum respirația, deglutiția dar și cele mai simple mișcări. Pacienții diagnosticați cu AMS de tip 1, netratați, necesită ventilație permanentă înainte de vârsta de 2 ani în peste 90% dintre cazuri. Peste 30% dintre pacienții cu AMS de tip 2 nu supraviețuiesc mai mult de 25 de ani. Costurile asociate îngrijirii pacienților cu AMS variază între 2.5 și 4 milioane de euro, în primii 10 ani de la diagnostic.
Zolgensma este o terapie genică, administrată printr-o injecție unică intravenoasă, ce presupune introducerea unei gene SMN1 în organismul pacientului.
AveXis a început negocierile cu reprezentanți din mai multe țări europene pentru asigurarea accesului rapid al pacienților la această nouă terapie cu potențial curativ prin programul „Day One”. Stabilirea prețului unui medicament în Europa variază în funcție de specificul fiecărui sistem de sănătate. Adesea se bazează pe negocieri între diferite instituții care pot întârzia semnificativ accesul pacienților la tratament.
Programul „Day One” asigură integritatea metodelor locale de stabilire a prețului și mecanismelor de rambursare prin existența mai multor opțiuni care pot fi adaptate:
- Posibilitatea de reduceri retroactive, astfel costurile necesare accesului rapid sunt aliniate cu prețurile negociate în urma evaluărilor clinice și economice locale;
- Sisteme de amânare a plăților și opțiuni de plată în rate, ceea ce le permite autorităților care se ocupă de rambursare să controleze impactul asupra bugetului în fazele inițiale de acces;
- Reduceri bazate pe rezultate, negociate în urma evaluărilor clinice și economice pot fi aplicate pacienților tratați în faza inițială de acces;
- Programe educaționale pentru instituțiile care oferă tratamentul – pentru proceduri legate de administrarea terapiei și îngrijirile de follow-up;
- Acces la un registru global al pacienților diagnosticați cu AMS, RESTORE, bazat pe registre existente ale diferitelor țări.
Studiile care au condus la aprobarea Zolgensma în UE
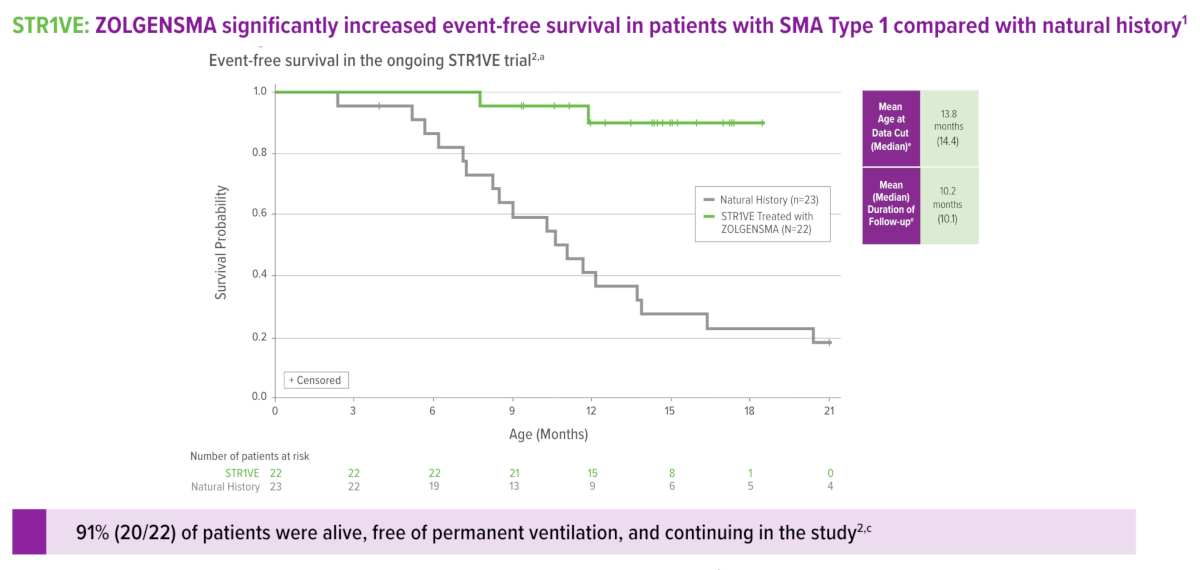
Aprobarea se bazează pe datele din studiul de fază 3, STR1VE-US și studiul de fază I, START care au evaluat eficacitatea și siguranța terapiei genice la pacienții simptomatici cu AMS tip 1, cu vârste de sub 6 luni la momentul administrării, care aveau una sau două copii ale genei SMN2 sau două copii ale genei SMN2. STR1VE-EU este un alt studiu de fază 3 aflat în desfășurare. S-a observat ameliorarea rapidă a funcției motorii, chiar la o lună de la administrare. Rezultatele sunt susținute – pacienții pot sta în șezut fără ajutor, pot merge singuri, funcții care nu ar putea fi niciodată atinse de un pacient cu SMA tip 1 netratat.
Studiul de fază 3 SPR1NT a evaluat tratamentul cu Zolgensma înainte de instalarea simptomelor, la pacienții cu vârste de sub 6 săptămâni, cu deleții bi-alelice ale genei SMN1, cu 2-3 copii ale SMN2. Datele sugerează faptul că pacienții se pot dezvolta normal, dobândind funcțiile motorii conform vârstei și sugerează importanța intervenției precoce.
Ce este atrofia musculară spinală?
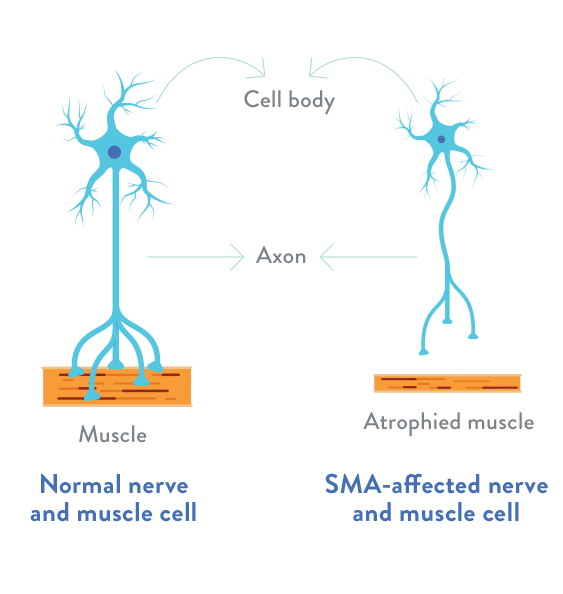
Atrofia musculară spinală reprezintă o boală genetică rară caracterizată printr-un deficit al proteinei SMN (survival motor neuron), care influențează dezvoltarea neuronilor motori. Neuronii motori transmit semnale de la măduva spinării și la nivel cerebral, care determină contracția mușchilor scheletici. Distrugerea acestor neuroni conduce la atrofie musculară și afectarea unor funcții vitale.
AMS de tip 1 este cea mai frecventă formă și determină o boală severă, în care simptomele sunt prezente la naștere sau până la vârsta de 6 luni. Mai puțin de 10% dintre pacienți supraviețuiesc după vârstă de 2 ani.
Proteina SMN este codificată de genele SMN1 și SMN2. Anomalii ale genei SMN1 determină obținerea unei proteine incomplete sau nefuncționale.
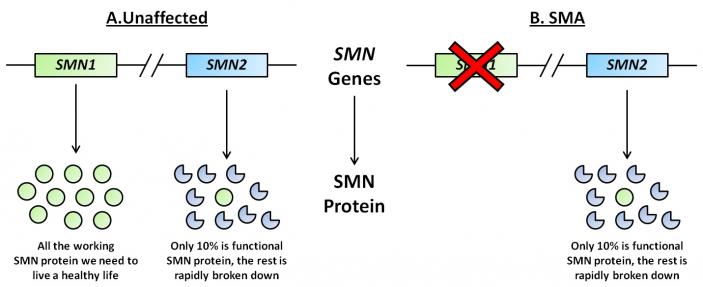
Acest deficit poate fi parțial compensat de gena SMN2. Numărul genelor SMN2 variază la fiecare persoană, însă cu cât sunt prezente mai multe copii, cu atât se va produce o cantitate mai mare de proteină și boala va avea o formă mai ușoară. Mutațiile de la nivelul genei SMN2 influențează severitatea bolii și determină tipul acesteia.
Citește și
- FDA a aprobat Zolgensma, prima terapie genică pentru atrofia musculară spinală
- Inovația anului 2019 pe Raportuldegardă.ro. Publicul și editorii au decis: Zolgensma, prima terapie genică pentru atrofia musculară spinală
- BREAKING NEWS. Luxturna, prima terapie genică aprobată de FDA pentru o boală ereditară care determină orbire

