Terapia genică Zolgensma primește recomandarea de aprobare în UE pentru tratamentul atrofiei musculare spinale
În urmă cu mai puțin de un an, Zolgensma (onasemnogene abeparvovec) devenea prima terapie genică aprobată de către FDA pentru pacienții cu vârsta de sub 2 ani cu atrofie musculară spinală (MSA) și mutație bialelică a genei SMN1 (survivial motor neuron).
Comitetul pentru medicamentele de uz uman (CMPH) din cadrul Agenţiei Europene a Medicamentului (EMA) a recomandat autorizarea de punere pe piaţă condiționată a Zolgensma (onasemnogene abeparvovec) pentru tratamentul pacienților cu atrofie musculară spinală tip 1 și mutație bi-alelică a genei SMN1.
Acest aviz favorabil este un pas important pentru pacienții cu atrofie musculară spinală din Europa.
„Opinia pozitivă pentru Zolgensma a CHMP marchează un pas important, mai aproape de aprobare din partea Comisiei Europene și de aducere în Europa a singurei terapii genice pentru MSA, care poate influența impactul devastator pe care îl are această afecțiune asupra pacienților și familiilor lor. Zolgensma oferă o cu totul altă metodă de tratament a acestei boli rare, dar debilitante, printr-o singură administrare și cu un potențial de salvare a vieții”, a declarat Dave Lennon, președintele AveXis, companie de biotehnologie deținută de Novartis, care dezvoltă tratamente pentru afecțiuni genetice rare neurologice.
Avizul favorabil din partea CHMP se bazează pe rezultatele studiilor care au evaluat eficacitatea și siguranța acestei terapii, și anume studiul de fază 3 STR1VE-US și studiul de fază 1 START. În cadrul acestora, Zolgensma a demonstrat creșterea supraviețuirii, îmbunătățirea funcțiilor motorii, uneori chiar la o lună de la administrare și achiziția unor funcții motorii noi, precum capacitatea de a sta în șezut fără sprijin, un deziderat neatins de către pacienții cu SMA tip 1 netratați.

De asemenea, date suplimentare provenite din studiul de fază 3 SPR1NT demonstrează achiziții motorii importante, corespunzătoare vârstei, atunci când s-au evaluat efectele administrării într-o singură doză i.v a Zolgensma la pacienți pre-simptomatici cu vârsta de sub 6 săptămâni. Aceste rezultate subliniază încă o dată importanța critică a intervenției terapeutice precoce în cadrul acestei afecțiuni.
Zolgensma® (onasemnogene abeparvovec) este un medicament care se adresează cauzei genetice a atrofiei musculare spinale. Printr-o singură injecție, este livrată o copie funcțională a genei SMN care oprește evoluția bolii prin producția susținută a proteinei SMN (survivial motor neuron), în lipsa căreia survine moartea neuronilor motori.
Zolgensma, singura terapie genică pentru SMA, a demonstrat beneficii clinice semnificative la pacienții simptomatici sau pre-simptomatici cu SMA, inclusiv prelungirea supraviețuirii, cu rezultate susținute chiar la 5 ani de la administrare.
„În cele mai severe forme ale bolii, pacienții pediatrici netratați nu își pot susține capul, nu pot sta în șezut sau chiar înghiți și în general nu supraviețuiesc peste vârsta de doi ani dacă nu sunt ventilați permanent. Rezultatele terapiei pe care le-am văzut în urma studiului STR1VE arată o rată de supraviețuire impresionantă, cu o majoritate a pacienților capabili să stea în șezut fără sprijin. De asemenea monitorizarea studiului START la aproximativ 4,5 ani ani mai târziu ne arată potențialul semnificativ pe termen lung pe care această terapie genică îl poate avea pentru copiii cu această boală rară” – a declarat Dr. Francesco Muntoni, profesor și medic neurolog pediatru la Spitalul de Copii Great Ormond Street din Londra.
Cele mai frecvente reacții adverse observate după administrarea Zolgensma au fost creșterea valorilor enzimelor hepatice și vărsăturile. Poate apărea chiar injurie hepatică acută cu hepatocitoliză, pacienții cu afectare hepatică pre-existentă având un risc mai mare. Înainte de administrarea terapiei trebuie evaluată funcția hepatică a tuturor pacienților prin examinare clinică și probe de laborator. De asemenea, se administrează corticoterapie sistemică tuturor pacienților, atât înainte, cât și după tratamentul cu Zolgensma și se continuă monitorizarea funcției hepatice pentru cel puțin 3 luni de la administrare.
Ce se va întâmpla în continuare?
Comisia Europeană examinează recomandările CHMP și de obicei elaborează decizia finală în aproximativ 2 luni. Această decizie va fi aplicabilă în toate cele 27 state al EU și de asemenea în Islanda, Norvegia, Liechtenstein și Marea Britanie.
„Având în vedere urgența tratamentului SMA și natura inedită a terapiei genice, trebuie să fim la fel de inovatori și în asigurarea accesului la tratament, astfel că oferim guvernelor și organismelor de rambursare un program de acces „Ziua Unu” pentru a permite accesul rapid la Zolgensma la aprobare.” – Dave Lennon, AveXis
Despre atrofia musculară spinală
SMA este o afecțiune neuro-musculară genetică rară, cauzată de un defect al genei SMN1, rezultând în pierderea funcției neuronilor motori rapid și ireversibil, cu afectarea funcției musculare, inclusiv a respirației, înghițitului și a mișcărilor de bază. Există mai multe tipuri ale acestei afecțiuni, tipul 1 fiind ce mai comun, dar și cel mai sever.
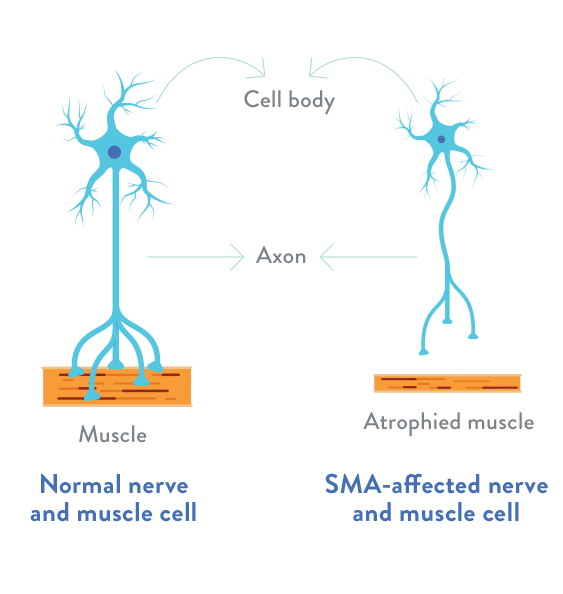
sursa: https://www.togetherinsma.com/
SMA este principala cauză ereditară de deces infantil. Netratată, SMA de tip 1 duce la deces sau la nevoia de ventilație permanentă (până la vârsta de 2 ani în 90% din cazuri).
Este foarte importantă diagnosticarea și tratamentul precoce al SMA cât mai devreme posibil pentru a împiedica progresia bolii și pierderea ireversibilă a neuronilor motori.
Acest lucru este deosebit de important în SMA tip 1, unde degenerarea neuronului motor începe chiar înainte de naștere și se petrece rapid. Pierderea neuronilor motori este un fapt ireversibil, astfel că pacienții cu simptome prezente la momentul începerii tratamentului vor necesita cel mai probabil suport respirator, nutrițional și/sau îngrijire musculoscheletală pentru a crește abilitățile funcționale.
În Europa se nasc anual aproximativ 550-600 de copii cu SMA. Această afecțiune reprezintă o povară semnificativă pentru sistemul de sănătate din Europa, cu un cost cumulativ per pacient estimat între 2,5 și 4 milioane de euro doar în primii 10 ani.
„Ne bucurăm să aflăm că Agenția Europeana a Medicamentului consideră un nou tratament eficient în combaterea SMA și că o parte a comunității noastre ar putea beneficia de acesta. SMA Europe va continua munca pentru ca toți pacienții care trăiesc cu SMA în Europa să aibă posibilitatea de a accesa orice tratament care poate fi benefic pentru ei în timp util și în mod susținut ”, a declarat Mencía de Lemus, președinte al asociației europene de atrofie musculară spinală.
Citește și:
- FDA a aprobat Zolgensma, prima terapie genică pentru atrofia musculară spinală
- Inovația anului 2019 pe Raportuldegardă.ro. Publicul și editorii au decis: Zolgensma, prima terapie genică pentru atrofia musculară spinală
- BREAKING NEWS. Luxturna, prima terapie genică aprobată de FDA pentru o boală ereditară care determină orbire

