Entrectinib este recomandat spre aprobare în UE pentru tumorile solide care exprimă fuziuni NTRK și pentru cancerul pulmonar non-microcelular ROS1+
Comitetul pentru Medicamente de Uz Uman (CHMP), din cadrul Agenției Europene a Medicamentului, a emis o recomandare pentru aprobarea de punere pe piață a medicamentului entrectinib (denumire comercială Rozlytrek) pentru tratamentul adulților și copiilor de peste 12 ani cu tumori solide care exprimă fuziuni NTRK, avansate local, metastazate sau nerezecabile chirurgical. Recomandarea se adresează și tratamentului adulților cu cancer pulmonar non-microcelular (NSCLC) avansat ROS1-pozitiv.
Entrectinib a primit Statut Prioritar (Priority Medicines) din partea EMA pentru tratamentul tumorilor solide cu fuziuni NTRK, avansate local sau metastazate, la pacienții adulți și pediatrici care fie au progresat după alte terapii, fie nu mai pot beneficia de tratamentele standard. Decizia finală din partea Comisiei Europene este așteptată în următoarele luni.
Înainte ca pacienții să primească tratamentul, mutația trebuie să fie confirmată cu ajutorul unor teste genetice valide, conform CHMP. Singura cale de a identifica pacienții eligibili de a primi tratamentul cu entrectinib este testarea biomarkerilor – fuziunile genei NTRK, în cazul tuturor tumorilor solide, și ROS1, în cazul NSCLC.

Enrectinib – răspunsuri durabile în mai multe tipuri de tumori, inclusiv cu diseminare cerebrală
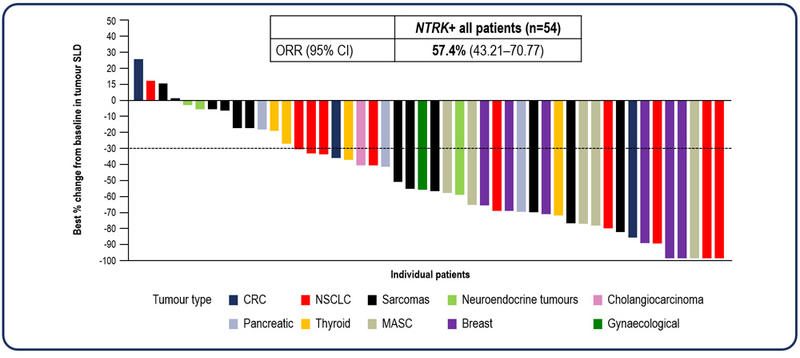
Recomandarea CHMP se bazează pe o analiză integrată care include date de la 74 de persoane cu tumori solide, pozitive pentru fuziunea NTRK, localizate sau metastazate (14 tipuri de tumori) și 161 de persoane cu cancer pulmonar non-microcelular (NSCLC), ROS1-pozitiv din studiile clinice: STARTRK-2 de faza II, STARTRK-1 de faza I și ALKA-372-001 de faza I. De asemenea, se bazează pe date din studiul STARTRK-NG de faza I/II la pacienții pediatrici. Studiile au înrolat persoane din 15 țări. Siguranța a fost evaluată pe baza unei analize integrate a 504 de persoane în aceste patru studii.
Pe parcursul acestor studii, entrectinib a fost evaluat în mai multe tipuri de tumori solide, incluzând sarcom, cancer pulmonar non-microcelular, carcinom secretor al glandelor salivare, cancer de sân secretor, cancer tiroidian, colorectal, neuroendocrin, pancreatic, ovarian, carcinom endometrial, colangiocarcinom, cancere gastrointestinale și neuroblastom.
Rezultatele au arătat:
- entrectinib a redus dimensiunile tumorale la mai mult de jumătate din persoanele cu tumori NTRK-pozitive, avansate local sau metastazate:
- rata globală de răspuns [ORR] de 63,5%);
- răspunsurile obiective au fost observate la 14 tipuri de tumori (durata medie a răspunsului [DoR] de 12,9 luni);
- În NSCLC ROS1-pozitiv, avansat:
- reducere tumorală la 73,4% dintre pacienți (ORR; după 12 luni de urmărire);
- durată medie a răspunsului de 16,5 luni;
- Într-un grup de 161 de pacienți (dintre care 29% cu metastaze ale sistemului nervos central), ORR a fost de 67,1%, după 6 luni de urmărire (răspunsurile obiective la entrectinib au fost observate la persoanele cu metastaze SNC la nivelul inițial, atât la populațiile NTRK, cât și ROS1-pozitive);
- La pacienții pediatrici:
- entrectinib a redus tumorile (ORR) la toți copiii și adolescenții care au avut fuziuni ale genei NTRK (N = 5);
- doi pacienți au obținut un răspuns complet (CR);
- doi pacienți cu tumori primare SNC de grad înalt au obținut răspunsuri obiective, inclusiv un pacient cu răspuns complet.
Studiile realizate în populația adultă
Entrectinib a determinat reducerea dimensiunilor tumorale, conform datelor unei analize a 3 studii care au inclus adulți cu tumori la care se identificau anomalii genetice specifice ale genei NTRK și ROS1:
- Studiul de fază II, STARTRK-2 este un studiu multicentric în care au fost înrolați pacienți cu tumori solide care prezentau mutații la nivelul genelor NTRK1/2/3, ROS1 și ALK;
- STARTRK-1 este un studiu de fază I multicentric desfășurat în SUA și Coreea de Sud care a stabilit schema recomandată de dozare a medicamentului;
- ALKA-372-001 este un alt studiu, desfășurat în Italia, care a evaluat schemele optime de dozare ale medicamentului. În cadrul studiului au participat pacienți cu tumori solide avansate care prezentau fuziuni la nivelul TRKA/B/C, ROS1 sau ALK.
Eficacitatea medicamentului în populația pediatrică
Studiul de fază I/II STARTRK-NG a înrolat pacienți cu vârsta cuprinsă între 4,9 luni și 20 de ani, cu tumori rare de sistem nervos central (SNC), neuroblastom sau alte tumori solide. Majoritatea pacienților cu tumori de SNC suferiseră anterior o intervenție chirurgicală pentru îndepărtarea tumorii și radioterapie.
Conform datelor prezentate anul trecut la ASCO, toți pacienții incluși în studiu au răspuns la tratament. Pacienții au înregistrat răspuns obiectiv la tratamentul cu entrectinib după o durată medie de 281 de zile de tratament, cu doze de cel puțin 400 mg/m². Răspunsul la entrectinib s-a obținut numai la pacienții care prezentau alterări genice țintite de tratament iar durata medie necesară pentru răspuns a fost de 57 de zile.
„Rezultatele ne arată că pacienții pediatrici cu forme de cancer amenințătoare de viață pot beneficia enorm, chiar și după ce alte terapii convenționale nu au funcționat. Răspunsurile înregistrate au fost rapide și durabile și ne sugerează că această terapie oferă o promisiune uriașă pentru acei copii cu tumori prezentând fuziuni specifice ale genelor”, a afirmat autorul studiului, Dr. Giles W. Robinson, medic pediatru neuro-oncolog la St. Jude Children’s Research Hospital, S.U.A.
Entrectinib – treatment „tumor agnostic”
Entrectinib este un medicament sistemic cu administrare orală, care penetrează și la nivelul sistemului nervos central. Este un inhibitor selectiv al tirozin-kinazei active a SNC și blochează activitatea proteinelor în legătură cu mutații ale NTRK 1/2/3, ROS1 și a genelor ALK. Fuziunea acestor gene conduce la proliferarea celulelor tumorale iar prin blocarea lor este promovată moartea celulelor canceroase. Entrectinib se distinge de celelalte medicamente din clasa sa prin spectrul larg de activitate – țintește mutații multiple.
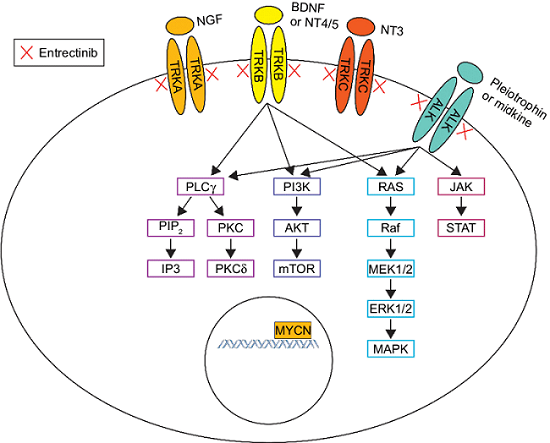
În vara anului 2019, Food and Drug Administration (FDA) a aprobat entrectinib printr-o procedură accelerată, pentru tumorile solide care prezintă fuziuni NTRK, la pacienții adulți și pediatrici. De asemenea, medicamentul a primit aprobare și pentru tratamentul cancerului pulmonar non-microcelular ROS1 pozitiv, la adulți. Acest moment marca a treia aprobare a unui tratament oncologic, indicat în funcție de prezența biomarkerilor moleculari și nu în funcție de localizarea tumorii.
În 2017, FDA aproba pembrolizumab pentru tumorile care prezintă instabilitate microsatelitară (MSI-H) iar în 2018, larotrectinib pentru tumorile care exprimă fuziuni NRTK. Tot în vara anului 2019, larotrectinib devenea primul medicament tumor-agnostic recomandat spre aprobare din partea Agenției Europene a Medicamentului.
Totuși, entrectinib este primul tratament aprobat de FDA care țintește ambele tipuri de anomalii genetice – NTRK și ROS1. O diferență importantă față de larotrectinib este activitatea asupra sistemului nervos central. Entrectinib determină răspunsuri și în cazul diseminărilor cerebrale. O treime dintre pacienții cu NSCLC prezintă metastaze cerebrale la momentul diagnosticului, iar două treimi dezvoltă astfel de metastaze în timpul tratamentului.
Citește și:
- FDA a aprobat a treia terapie de tip „tumor-agnostic”, entrectinib, cu indicații în cancerele care exprimă fuziuni NTRK și în cancerul pulmonar ROS1+
- #ASCO19. Terapia țintită cu entrectinib determină răspuns la copiii cu tumori solide care prezintă fuziuni genetice specifice
- #ASCO19. Modificările genetice care pot fi țintite prin terapii specifice în cancerele pediatrice sunt mai frecvente decât se considera anterior

