Noi recomandări ASCO: testarea genomică somatică ar trebui să fie parte din standardul clinic pentru tumorile solide avansate
Înțelegerea modului în care testele genomice pot fi integrate în practica medicală este o provocare din ce în ce mai mare, având în vedere progresele în domeniul oncologiei. Pe plan internațional se observă o creștere importantă a numărului de terapii țintite și imunoterapii aprobate pentru a trata cancerele în funcție de prezența biomarkerilor. Cu toate acestea, există o lipsă de claritate cu privire la momentul recomandării secvențierii genomului tumoral, la ce tip de teste ar trebui recomandate și interpretarea rezultatelor pentru selectarea tratamentului.
Societatea Americană de Oncologie Clinică (ASCO) a reunit un comitet de experți pentru a genera recomandări cu privire la utilizarea secvențierii genomice pentru informarea deciziilor cu privire la terapiile oncologice pentru cancerele solide avansate/metastatice. Aceștia au analizat terapiile autorizate, datele disponibile despre prevalența biomarkerilor și opiniile experților internaționali pe aceste teme. Prin emiterea unui document de tip Provisional clinical opinion (PCO), ASCO își propune să ofere îndrumare medicilor pentru implementarea timpurie a rezultatelor din studii clinice cu potențialul de schimba practica medicală. Recomandările ASCO au fost publicate pe 17 februarie în Journal of Clinical Oncology.
În 2020, FDA a aprobat 28 de terapii țintite în funcție de biomarkeri moleculari și multe studii clinice folosesc datele care provin din secvențierea genomică pentru a defini eligibilitatea pacienților pentru un anumit tratament. Categoriile de pacienți care pot beneficia în urma testării panelurilor multigenice s-au extins odată cu aprobările de tip tissue agnostic, acestea fiind indicate pentru orice tip de cancer, indiferent de localizare, care prezintă anumiți markeri precum TMB-H (încărcătură ridicată a mutațiilor tumorale), dMMR (marker ce indică un deficit de reparare ADN) sau fuziuni NTRK.
Conform comitetului, există suficiente dovezi științifice care justifică rolul testării genomice în practica medicală pentru pacienții oncologici.
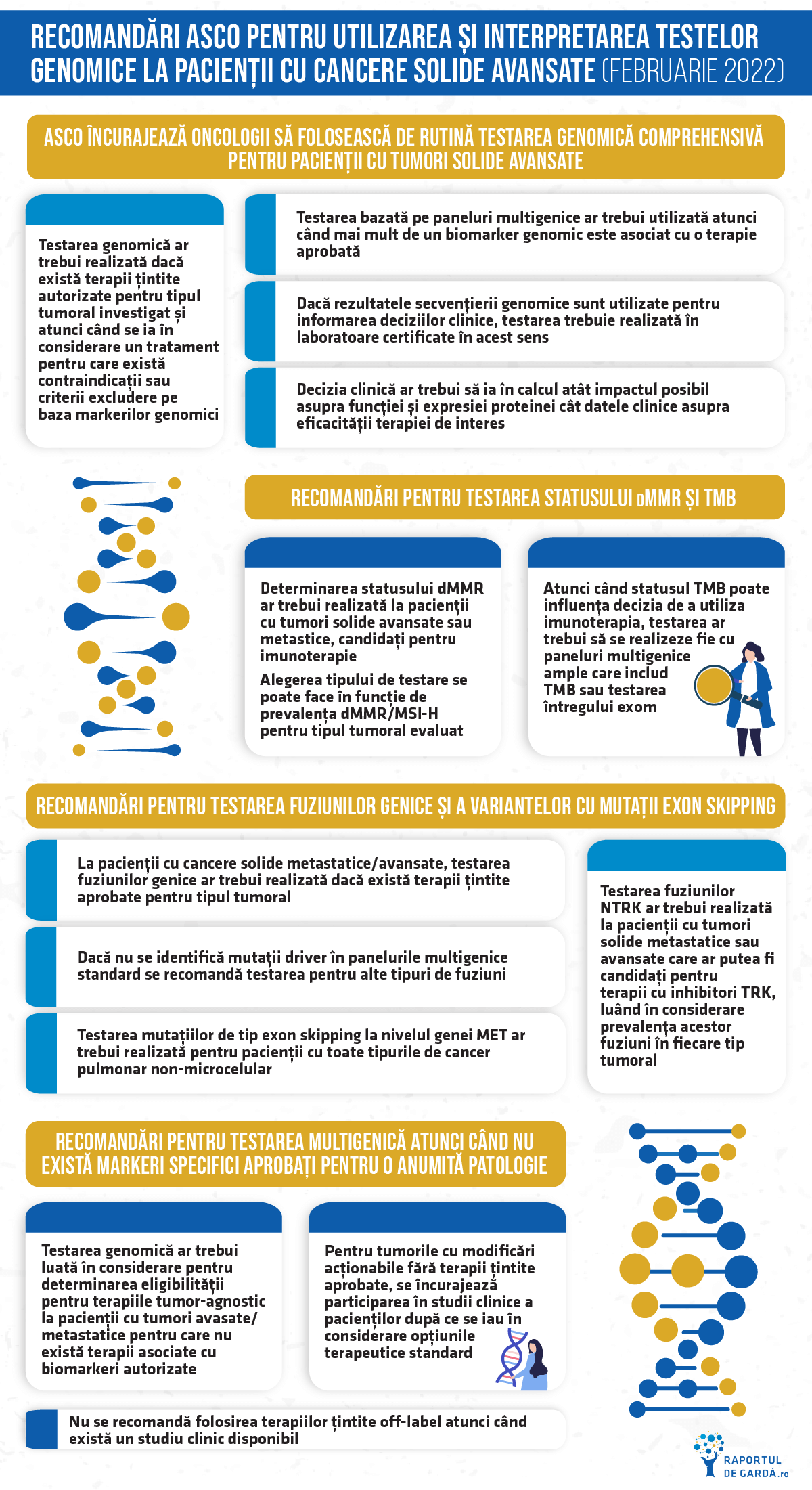
ASCO încurajează oncologii să folosească de rutină testarea genomică pentru pacienții cu tumori solide avansate. Se recomandă testarea multigenică și nu testarea secvențială de biomarkeri.
Pacienții cu cancer metastatic sau avansat ar trebui să primească indicația de testare prin secvențiere genomică tumorală într-un laborator certificat, dacă prezența anumitor biomarkeri poate ghida administrarea unui anumit tratament autorizat sau dacă poate exclude un anumit tratament. Testele bazate pe paneluri multigenice trebuie utilizate ca abordare standard dacă există mai mult de un biomarker pentru care există terapie autorizată în cadrul tipului tumoral evaluat. Deși anumite terapii poate fi administrate pe baza realizării unui test companion diagnostic (CDx) ce nu folosește NGS, testarea multigenică e cea mai potrivită metodă de a utiliza o cantitate limitată de țesut, permițând testarea simultană a mai multor ținte terapeutice.
Deși toate terapiile țintite, ghidate de anomalii genomice, au fost aprobate până acum pentru stadiile metastatice de boală, rolul acestora începe să fie demonstrat și în stadii mai puțin avansate. De exemplu, în 2018, FDA a aprobat combinația dabrafenib și trametinib pentru tratamentul adjuvant al melanomului BRAF+ iar în 2021 a aprobat osimertinib pentru tratamentul adjuvant al NSCLC EGFR+. Comitetul ASCO anticipează o creștere a rolului terapiilor țintite în stadiile adjuvante/neoadjuvante și o creștere a utilizării testării genomice în stadiile mai puțin avansate de cancer.
Cancerul pulmonar reprezintă un reper pentru potențialul medicinei de precizie. Înțelegerea cauzelor genetice ale bolii și a mecanismelor imune implicate în cancer a condus la dezvoltarea de terapii mai eficiente și mai sigure. În prezent, mai mult de jumătate din cazurile de cancer pulmonar prezintă mutații acționabile. Atât terapia țintită bazată pe molecule mici, cât și imunoterapiile, încep să fie aplicate cu succes și în stadii incipiente de boală, conform celor mai recente date din studiile clinice, astfel încât, perspectiva vindecării devine posibilă.
Aprobările de terapii cu indicații tip tissue agnostic (pe baza biomarkerilor TMB-H, dMMR sau NTRK) justifică recomandarea de testare genomică a tuturor tumorilor solide.
Comitetul ASCO a luat în considerare și direcțiile de cercetare cu care ar trebui să fie la curent clinicienii:
- Determinarea statusului dMMR (mismatch repair deficiency status), care indică deficitul de reparare ADN, ar trebui evaluat la pacienții cu cancere avansate care sunt candidați pentru imunoterapie.
- Atunci când TMB poate influența decizia de a utiliza imunoterapia, testarea ar trebui să se realizeze fie cu paneluri multigenice ample care includ TMB sau testarea întregului exom
Testarea de tip single gene nu poate determina cu acuratețe dMMR/ MSI-H sau TMB. Determinarea instabilității genomului (MSI/dMMR) și a încărcăturii mutaționale tumorale (TMB) reprezintă biomarkeri care au fost folosiți mai ales în cercetare până acum. Instabilitatea microsatelitară, MSI (microsatellite instability) a fost primul biomarker care a condus la aprobarea unui medicament oncologic (un inhibitor al punctelor de control) pentru o indicație tumor-agnostic (independent de localizarea tumorii). ADN-ul din celulele umane conține segmente scurte repetitive numite microsateliți, care sunt indicatori ai stabilității ADN-ului. MMR (DNA mismatch repair) este un proces prin care se verifică modul de copiere al ADN-ului, astfel încât acesta să se producă fără erori, iar repetițiile microsatelitare să rămână la fel în toate celulele. La anumiți pacienți procesul este defectuos.
dMMR nu este însă un biomarker clasic. Dovada fenotipică a acestui tip de deficit de reparare ADN poate fi cuantificată prin determinarea statusului MSI prin PCR sau prin imunohistochimie (IHC) pentru detectarea a patru proteine MMR inactivate. Includerea termenului dMMR în rezumatul caracteristicilor produsului pentru imunoterapia pembrolizumab se referă la determinarea dMMR prin IHC. Deși ambele metode pot fi realizate pentru testarea tumorală, această strategie nu este posibilă dacă există o cantitate limitată de țesut. Alegerea dintre un panel multigenic și o strategie țintită de testare trebuie să fie individualizată, ținând cont de costuri și de disponibilitatea țesutului sau posibilitatea de înrolare în studiu clinic.
TMB este un biomarker care descrie rata generală de mutații somatice, fiind folosit pentru identificarea persoanelor care pot beneficia de imunoterapie pornind de la ipoteza că anumite tumori solide sunt imunogene. S secvențierea exomului (WES, whole exome sequencing) este metoda cu cea mai mare acuratețe pentru determinarea TMB.
Algoritmul decizional clinic ar trebui să includă impactul cunoscut sau anticipat al unei modificări genomice asupra expresiei proteinei sau funcției proteinei și datele clinice asupra eficacității țintirii acelei modificări cu un anumit agent terapeutic.
O provocare în oncologia de precizie este determinarea efectului mutațiilor genetice identificate (dacă sunt mutații driver acționabile sau neacționabile sau dacă sunt de tip passenger). Nu toate modificările din genele acționabile se traduc prin sensibilitate la terapiile disponibile. De exemplu, inhibitorii BRAF vemurafenib și dabrafenib aprobați pentru mai multe tipuri tumorale specifică indicația în mutațiia BRAF V600E și nu alte tipuri de mutații ale genei BRAF.
Mutațiile driver sunt acele anomalii care au un rol major în inițierea și în progresia dezvoltării tumorale. Ele se regăsesc mai des la nivelul regiunilor codante ale genomului și mai frecvent au origine somatică. Restul genelor mutante sunt numite gene pasager (passenger genes), care nu determină fenotipul bolii însă pot deveni driver. Cele mai multe modificări detectate prin secvențiere genomică sunt de tip passenger, fără semnificație asupra dezvoltării cancerului. Mutațiile driver acționabile de obicei activează o kinază direct sau indirect iar agentul terapeutic este un inhibitor al acestei kinaze. Cu toate acestea, anumiți biomarkeri acționabili sunt gene supresoare tumorale.
Atunci când interpretează rezultatele testării genomice, clinicienii ar trebui să ia în considerare atât lista de mutații identificate în raport cât și comentariile asupra implicațiilor funcționale.

Testarea liniei germinale
Testarea liniei germinale și sfatul genetic ar putea fi necesare la pacienții cu istoric personal sau familial sugestiv pentru o anumită predispoziție, chiar dacă nu sunt identificate mutații germinale în timpul secvențierii genomice tumorale prin intermediul diferitelor paneluri. Secvențierea genomului tumoral nu ar trebui să înlocuiască testarea germinală specifică. Pacienții cu variante patogene sau posibil patogene ar trebui să primească sfat genetic pentru înțelegerea riscului de cancere secundare, de transmiterea mutațiilor în familie și diferențele dintre mutațiile somatice și cele germinale. ASCO a inițiat un nou ghid asupra testării germinale, care include precizări privind sfatul genetic, care urmează a fi publicat în primăvara anului 2023.
Cele mai multe forme de cancere sunt sporadice, determinate de mutații dobândite, numite mutații somatice. Aceste variante nu se găsesc în toate celulele organismului și nu se transmit între generații. În alte cazuri, mutațiile care sunt detectate în celulele tumorale pot fi prezente și în restul celulelor organismului, reprezentând variante genetice moștenite. Acestea sunt numite mutații germinale (au fost prezente la nivelul celulelor reproductive, din care s-a dezvoltat întregul organism). Cancere derivate din aceste mutații sunt ereditare. Testarea genomică somatică presupune testarea acizilor nucleici de la nivel tumoral sau prin biopsie lichidă. În funcție de tipul de cancer, se poate realiza atât testarea mutațiilor somatice cât a celor germinale pentru selectarea opțiunilor terapeutice.
Testarea fuziunilor genetice și variantelor cu mutații de tip exon skipping
Țintirea fuziunilor genice este un alt domeniu terapeutic în care s-au realizat progrese importante în ultimii ani Frecvența fuziunilor genetice este variabilă în funcție de tipul bolii. În cazul cancerelor în care fuziunile sunt frecvente, cum este cancerul pulmonar este important ca aceste teste sa fie incorporate în panelul multigenic.
Testarea fuziunilor NTRK ar trebui realizată la pacienții cu tumori solide metastatice sau avansate care ar putea fi candidați pentru terapii cu inhibitori TRK, luând în considerare prevalența acestor fuziuni în fiecare tip tumoral.
Testarea mutațiilor de tip exon skipping la nivelul genei MET ar trebui realizată pentru pacienții cu toate tipurile de cancer pulmonar non-microcelular.
Testarea genomică ar trebui luată în considerare pentru a determina eligibilitatea pentru terapii tumor agnostic la pacienții cu tumori solide avansate pentru care nu există terapii țintite autorizate.
De fiecare dată când este posibil, medicii trebuie să înroleze pacienții în studii clinice pe baza prezenței biomarkerilor și nu doar să administreze terapiile off-label.
Modificările genomice pot fi considerate ținte terapeutice off-label dacă există argumente științifice solide și în funcție de scenariile clinice. Dar răspunsul într-un anumit tip tumoral nu garantează un răspuns similar și într-un alt tip de cancer. Este important să se înțeleagă modul în care anumite mutații afectează funcția unei gene și cum influențează sensibilitatea sau rezistența la o anumită terapie în contextul clinic specific pacientului. De aceea, ASCO încurajează înrolarea pacienților în studii clinice de câte ori este posibil în loc de folosirea terapiilor off-label pentru asigurarea accesului la terapii eficiente pentru un număr cât mai mare de pacienți.
O altă provocare este legată de faptul că studiile clinice randomizate nu sunt întotdeauna utile pentru demonstrarea beneficiilor testării genomice. Noile tipuri de studii care se concentrează pe anumiți biomarkeri sau pe subtipuri de boală pot demonstra valoarea inovațiilor în domeniul genomicii pentru pacienții oncologici. Informațiile din noul document ASCO au rolul de a stimula descoperiri legate de biomarkerii de prognostic și terapeutici.
Testarea biomarkerilor în România
Pe măsură ce terapiile oncologice avansează și devin din ce în ce mai precise, și tehnicile de testare utilizate trebuie adaptate și adoptate de către fiecare sistem medical. Un raport publicat în 2021 demonstra că deși în România au intrat pe piață și au fost rambursate tot mai multe terapii țintite, lipsa accesului la diagnosticul de precizie a făcut ca această disponibilitate a terapiilor să nu se reflecte în supraviețuirea pacienților.
Centrul pentru Inovație în Medicină a publicat Carta Albă a biomarkerilor în cancerul pulmonar non-microcelular, un document care descrie evoluția testării moleculare în cancerul pulmonar non-microcelular (NSCLC) și beneficiile aduse în ceea ce privește supraviețuirea pacienților cu acest tip de cancer. Tot în anul 2021 a fost lansat și un document de poziție asupra Implementării testării NTRK în sistemul de sănătate din România, care ar putea reprezenta un model pentru medicina personalizată.
Citește și:
- Raportul „Unlocking the potential of precision medicine in Europe”: accesul redus la testarea biomarkerilor în UE limitează implementarea medicinei de precizie în oncologie. Care este situația României?
- STUDIU. Prin testare comprehensivă genomică pot fi identificate mutații acționabile la 80% din pacienții cu cancere avansate

