FDA aprobă combinația encorafenib/cetuximab, primul regim țintit, non-chimioterapic, în cancerul colorectal metastatic BRAF V600E pozitiv
Administrația Alimentelor și Medicamentelor din SUA (FDA) a aprobat encorafenib, inhibitor al kinazei BRAF (Braftovi, Array BioPharma, parte a Pfizer), în combinație cu cetuximab (Erbitux, Lilly), un anticorp monoclonal anti-EGFR, pentru tratamentul pacienților cu cancer colorectal metastatic, care prezintă mutația BRAF V600E și care a progresat sub terapie anterioară. Aprobarea a survenit în urma unei proceduri accelerate, encorafenib fiind considerat terapie inovatoare (“Breakthrough Therapy Designation”).
„Se estimează că mutațiile BRAF sunt întâlnite la până la 15% dintre persoanele cu cancer colorectal metastatic și asociază un prognostic rezervat pentru aceștia. Combinația encorafenib-cetuximab este primul și singurul protocol terapeutic țintit pentru pacienții cu cancer colorectal metastatic BRAF V600E pozitiv care nu au răspuns la terapii anterioare”- Dr. Scott Kopetz, Conferențiar la Centrul de Oncologie MD Anderson, din cadrul Universității din Texas, Houston, SUA.
Aprobarea are la bază rezultatele pozitive asupra supraviețuirii globale din studiul BEACON CRC, publicate în New England Journal of Medicine. În cadrul Simpozionului ASCO 2020 au fost prezentate date suplimentare despre impactul terapiei asupra calității vieții acestor pacienți.
Studiul BEACON CRC este unul multicentric de fază III, randomizat, controlat activ, deschis. Cei 665 de pacienți incluși au fost diagnosticați cu cancer colorectal metastatic, care a progresat după una sau două linii de tratament, BRAF V600E pozitiv, conform unui test PCR, aprobat FDA. Acesta a urmărit eficiența dublei și triplei terapii față de grupul de control:
- Tripla terapie: cetuximab+encorafenib+binimetinib (inhibitor MEK);
- Dubla terapie: cetuximab+encorafenib;
- Control: cetuximab împreună cu chimioterapie (irinotecan, singur sau impreună cu acid folinic și fluorouracil- FOLFIRI).
În ambele grupuri intervenționale s-au înregistrat răspunsuri superioare grupului de control, dar doar dubla terapie a primit aprobarea FDA. Supraviețuirea globală în grupul cu triplă terapie a fost de 9 luni, în grupul cu dublă terapie 8,4 luni, față de 5,4 luni în grupul de control.
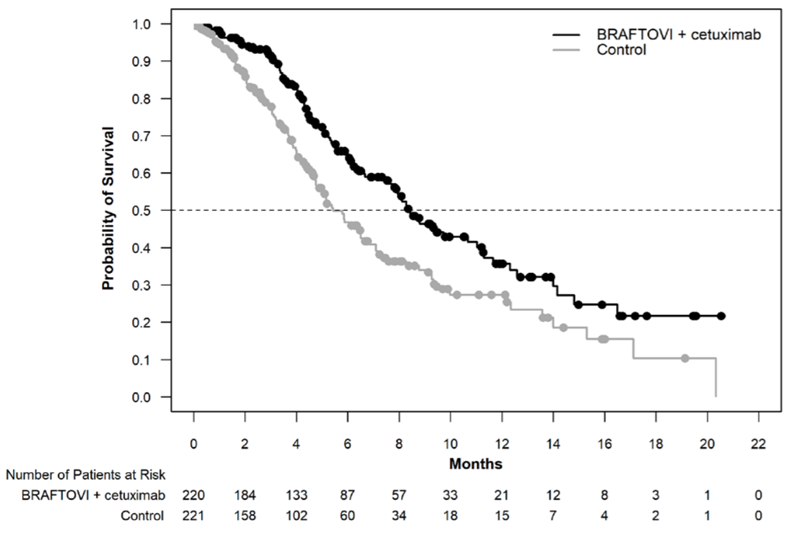
Rata obiectivă de răspuns a fost de 26% în grupul cu triplă terapie, 20% în grupul cu dublă terapie, ambele semnificativ mai mari față de rata de răspuns de 2% a grupului de control.
Reacții adverse severe au fost înregistrate la 58% dintre pacienții grupului cu triplă terapie, la 50% dintre pacienții grupului cu dublă terapie și la 61% dintre pacienții grupului de control. Cele mai comune reacții adverse (întâlnite la mai mult de 25% dintre pacienți) au fost: greață, astenie, diaree, dermatită acneiformă, dureri abdominale, scădere a apetitului, artralgii și rash.
Despre encorafenib și cetuximab
Encorafenib este un inhibitor oral cu moleculă mică a kinazei BRAF, iar cetuximab este un inhibitor cu moleculă mică a căii de semnalizare MAPK. Activarea anormală a acestor căi a fost demonstrată în mai multe tipuri tumorale, inclusiv melanom și cancer colorectal.
Combinația encorafenib-cetuximab mai este aprobată de către FDA pentru tratamentul melanomului nerezecabil sau metastatic care prezintă mutație BRAF V600E sau BRAF V600K și de către EMA (Agenția Europeană a Medicamentului) pentru melanomul BRAF V600-pozitiv.
Cancerul colorectal este al treilea cel mai comun cancer la bărbați și al doilea cel mai comun la femei (după cancerul mamar). Din ce în ce mai multe studii arată creșterea supraviețuirii și calitatății vieții cu ajutorul imunoterapiilor. Acestea ar putea deveni noile standarde terapeutice, înlocuind chimioterapia.
Citește și:
- #GI20. Tinerii diagnosticați cu cancer colorectal au șanse mai mici de supraviețuire dacă provin din zone cu un nivel scăzut de educație și venituri reduse
- #GI20. Studiul TAPUR: terapiile țintite, eficiente în cancerul colorectal avansat, la pacienții care prezintă anomalii moleculare specifice
- Scăderea vârstei de începere a screeningului pentru cancerul colorectal, de la 50 la 45 de ani, ar putea evita 11.000 de decese în SUA. Ce spun experții prezenți la Gastrointestinal Cancers Symposium 2020?
Sursă elemente imagine feature: freepik.

