Unu-la-unu cu Dr. Marius Geantă: Dr. Mor Moscovitz, despre testarea comprehensivă genetică în cancerul pulmonar. Când și cum testăm biomarkerii?
În ultimii ani asistăm la o schimbare de perspectivă în tratamentul cancerului. Dincolo de clasificarea clasică a cancerelor în funcție de localizare, testările moleculare permit acum divizarea acestora în subgrupuri de prognostic și modalități de tratament diferite, în funcție de profilul genomic tumoral.
Dr. Mor Moscovitz, medic oncolog specializat în tratamentul cancerului pulmonar, de la Spitalul Rambam din Haifa, Israel, a explicat pentru publicul Raportuldegarda.ro importanța testării genetice comprehensive în practica medicală. Aceasta a fost invitata domnului Dr. Marius Geantă, președintele Centrului pentru Inovație în Medicină, în emisiunea Unu-la-Unu cu Dr. Marius Geantă.
Punctele cheie atinse în această discuție au fost:
- Utilizarea medicinei genomice în practica medicală;
- Rolul biomarkerilor în identificarea tratamentului potrivit pentru pacientul potrivit;
- Cost-eficiența utilizării testelor genetice comprehensive;
- Importanța datelor în personalizarea tratamentului.
Dr. Marius Geantă: În Haifa sunteți foarte avansați în ceea ce privește medicina genomică în practica clinică, nu doar în cercetare și în teorie. Aria dvs. de expertiză este cancerul pulmonar – cum s-a schimbat perspectiva în cancerul pulmonar și șansele de supraviețuire pentru pacienții oncologici cu boală avansată în ultimii ani?
„În ultimii 10 ani am asistat la o schimbare masivă în cancerul pulmonar, de la situația în care nu aveam nimic să oferim pacienților, în afara standardului terapeutic – chimioterapia cu platină pentru toți pacienții, ne aflăm acum într-un punct unde cunoaștem și putem recunoaște multe subtipuri de cancer pulmonar. Aceste subtipuri variază din punct de vedere molecular și clinic, și putem oferi terapii diferite fiecărui subgrup de pacienți, iar acest lucru a crescut dramatic ratele de supraviețuire. Știm că există subtipuri de cancer pulmonar non-microcelular, precum cel ALK pozitiv și EGFR pozitiv, în care poate fi atinsă o supraviețuire mediană totală cu durata de mulți ani. Peste 3 ani în cazul pacienților cu cancer pulmonar EGFR pozitiv și aproape 5 ani pentru pacienții ALK. Așadar prin identificarea acestor grupuri mici, putem oferi acestor pacienți terapii mai bune, țintite, care le pot prelungi viața.
Iar un alt tratament care a revoluționat cancerul pulmonar este imunoterapia. Știm că există un anumit procent de pacienți, cel puțin 20%, pentru care noile trialuri clinice oferă un răspuns mai bun utilizând imunoterapii și știm că pacienții care răspund la imunoterapii vor trăi mai mult. Am văzut la congresul ESMO date despre supraviețuirea la 5 ani cu Keytruda și cu Opdivo. Avem rate de supraviețuire de care nu mai auzisem până acum în cancerul pulmonar metastatic” – Dr. Mor Moscovitz
- Zilnic se descoperă noi biomarkeri și noi indicații, noi idei asupra modului de utilizare a biomarkerilor și medicinei genomice. De ce este medicina genomică atât de diferită? De ce ar trebui să privim către medicina genomică și secvențierea ADN în mod diferit de modul în care privim testele uzuale de diagnostic?
„Pacienții oncologici sunt diferiți, neoplasmele diferă în funcție de localizarea tumorii (cancer de sân, colorectal, pulmonar), dar și în funcție de mecanismele genomice care au inițiat mutațiile. Așadar considerăm că tumora a luat naștere în primul rând din cauza schimbărilor genomice. De fapt, cunoaștem că pentru majoritatea cancerelor a existat o alterație genomică care a permis ca tumora să se dezvolte, iar dacă putem identifica aceste schimbări genomice, putem alege terapia pe care pacientul o primește și influența întregul management al bolii, nu doar terapia țintită. Acum știm că pacienții care au același tip de neoplasm, sunt împărțiți în subgrupuri cu prognostic diferite și nevoi terapeutice diferite. Așadar există variante clinice diferite, precum cancerul de colon drept și cancerul de colon stâng, care primesc terapii diferite, dar cel mai nou mod de a selecta pacienții este prin prisma schimbărilor moleculare, adică în funcție de profilul genetic care permite tumorii să crească și să se dezvolte. Și observăm acest lucru în cancerul pulmonar.
„Am început să vedem această diferențiere și în cancerul mamar, mai ales în grupul triplu negativ, dar cred că principala și majora schimbare a fost în cancerul pulmonar. Am început cu EGFR – această mutație a fost prima testată în urmă cu 10 ani la întreaga populație NSCLC. Nu am observat beneficii la majoritatea pacienților, iar apoi am realizat că există un subgrup care ar putea beneficia mai mult, iar apoi am identificat mutația EGFR. Și urmărind mutația EGFR am descoperit o altă mutație, numită ALK, care nu este de fapt o mutație, ci un rearanjament, fuziunea a două gene, iar acum când recunoaștem această schimbare putem găsi un tratament potrivit și putem dezvolta noi terapii bazându-ne pe această alterare genetică specifică și mecanismul de rezistență. Și observăm acest lucru cel mai bine cu EGFR- recunoaștem mutația inițială, apoi administrăm terapia țintită, un inhibitor EGFR, iar apoi, după o mediană de 1 an sau mai mult, apare aceeași mutație de rezistență, T790M, iar această identificare a mutației specifice ne-a permis să dezvoltăm un medicament specific care va ținti mutația, prelungind astfel semnificativ viața pacienților.”
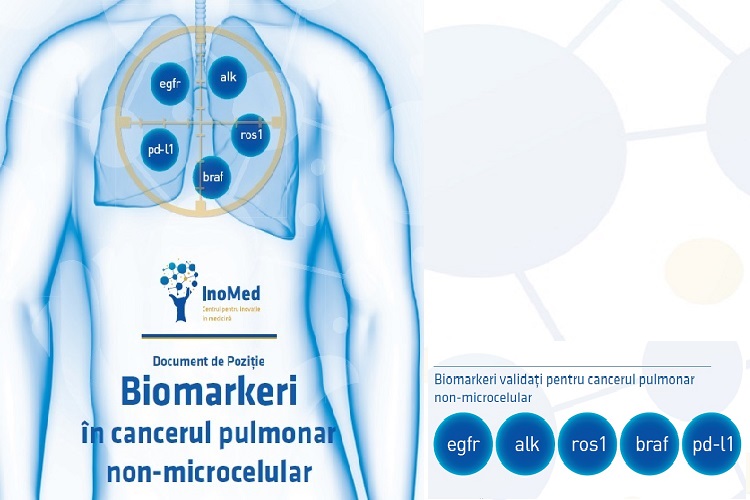
Am văzut prezentate la ESMO rezultatele studiului FLAURA, cu osimertinib vs. inhibitori de tirozin-kinază (TKI) în prima linie. Deci osimertinib țintește mutația EGFR principală și T790M și am văzut o creștere a supraviețuirii generale cu 7 luni cu noul agent, comparativ cu prima generație de TKI EGFR, iar acest lucru este fantastic. Am observat o supraviețuire mediană de peste 3 ani, ceea ce este minunat comparativ cu supraviețuirea generală în cazul NSCLC metastatic. Aceasta este importanța identificării schimbărilor moleculare.
Și avem noi ținte care apar în NSCLC, precum inhibitorii RET, LOXO-292, care au demonstrat rate de răspuns foarte bune, de aproximativ 70% și o durată mediană de răspuns de 12 luni ceea ce este enorm dacă ne uităm la pacienții RET care au o formă a bolii foarte agresivă. Și vedem, de asemenea, inhibitorii MET și HER2 și inhibitorii EGFR(exon 20), ceva ce nu aveam în trecut. Așadar viitorul este promițător și atâta vreme cât identificăm mai multe ținte, putem dezvolta mai multe terapii” – Dr. Mor Moscovitz
Aflați mai multe date despre despre rolul biomarkerilor și ce înseamnă personalizarea tratamentului în cancerul pulmonar nonmicrocelular, din cel de-al treilea episod ReGândim Medicina.
- Ați explicat foarte bine beneficiile aduse pacienților, dar și pentru medici și sistem, deoarece prin identificarea biomarkerilor, evităm reacțiile adverse și costurile inutile. Și astfel identificăm o metodă cost-eficientă de a cheltui banii. Următoarea mea întrebare ar fi: avem un panel de biomarkeri, care este metoda corectă de a-i testa, din experiența dvs.? Sau câte potențiale metode există pentru a pune în evidență acești biomarkeri, pentru cancerul pulmonar?
„Știm că există paneluri mari care ne pot facilita examinarea foarte bună și amănunțită a tuturor mutațiilor și alterațiilor genetice despre care am discutat, precum platforma Foundation Medicine, care analizează sute de gene în profunzime și știm că atunci când testăm acest panel, suntem acoperiți. Acest panel evaluează totul, substituțiile ale unor baze azotate, mutațiile nucleotidice unice, amplificații și fuziuni, care sunt cele mai greu de identificat atunci când căutăm alterări moleculare, dar suntem conștienți de faptul că aceste testări sunt costisitoare și știm că atunci când discutăm despre o testare genomică completă, dacă vrem să facem asta pentru toți pacienții, implică un cost semnificativ.
Există opțiunea de a testa paneluri mai mici, care pot fi făcute la nivel local, în laboratorul de patologie local. Așadar în Israel, la institutul meu, eu și anatomopatologul meu suntem foarte apropiați, iar el lucrează cu un panel mic, de 20 de gene, care acoperă mutațiile de bază care mă interesează. Acest panel este rezonabil din punct de vedere al costului, poate fi testat la toți pacienții, iar dacă simt că pacientul are o alterație moleculară pe care n-am găsit-o, dacă văd un pacient cu cancer pulmonar, dar este tânăr, n-a fumat niciodată și nu se încadrează în profilul pacientului cu cancer pulmonar atunci îi ofer panelul mai larg sau îmi rog anatomopatologul să se mai uite o dată sau să încerce un test mai puțin comun pentru acel pacient. Având la bază această informație, decidem dacă este necesar să facem un test FMI sau un test care include sute de gene”.
- Cât de importantă este partea analitică? Am discutat despre medicina genomică și panelul de 20 de gene, de 300 de gene. Aparatura NGS joacă un rol important, dar, de asemenea, și partea analitică, partea care implică datele. Ce părere aveți?
„Testările genomice sunt alcătuite din partea tehnică, care este panelul NGS, panelul de fuziune, dar și din bioinformatică. Avem nevoie să știm cum să interpretăm informația și ce să facem cu ea. Este foarte important lucrul în aceeași echipă a bioinformaticianului sau patologului molecular și a medicului oncolog, pentru a ști după ce ne uităm și ceea ce vrem să tratăm. Vă voi da un exemplu, cea mai comună mutație din cancerul pulmonar este mutația KRAS, există la 25-30% dintre pacienți, și până de curând nu am avut absolut nimic de făcut cu această informație, deoarece nu există o terapie țintită pentru KRAS. Au existat multe tratamente care au fost testate și au eșuat și, prin urmare, nu prea conta ce mutație KRAS aveam. Acest lucru a fost valabil până acum o lună, când am auzit la World Lung datele despre un inhibitor KRAS, un inhibitor specific KRAS, G12C, care a demonstrat rezultate foarte bune, cu răspuns de durată bun, atât în cancerul pulmonar, cât și în cancerul de colon.”
”Acum este important să cunoști ce fel de mutație KRAS are pacientul. Deci nu mai este vorba despre mutația KRAS, ci trebuie să știm care mutație KRAS. În viitor, când vom avea un studiu clinic sau când vom avea medicamentul disponibil, putem oferi asta pacientului. Așadar este important să știm ce anume căutăm, specific ce ținte, și apoi care sunt tratamentele disponibile sau care sunt studiile clinice disponibile pentru acești pacienți.
Un alt exemplu sunt genele care sunt implicate în repararea ADN, precum BRCA. Avem disponibil un grup de tratamente create pentru mutațiile genelor de reparare ADN, inhibitorii PARP. Folosim acești inhibitori în principal în cancerul ovarian, dar acum ne uităm la acțiunea acestor agenți în alte tipuri tumorale, pacienți specifici, care au mutații ale genelor de reparare ADN. Testul Foundation ne oferă o listă de gene care sunt potențial implicate în repararea ADN și dacă apare o mutație într-una dintre ele, atunci poate că-i putem oferi pacientului un studiu clinic cu inhibitori PARP. Acesta este un alt exemplu în care trebuie să știm exact ceea ce căutăm și ce să facem cu rezultatele. Facem aceste lucruri în Israel ca parte a unui „tumor board” genomic care implică atât patologi, cât și oncologi medicali și pe oricine mai este interesat de subiect. De fapt, atunci când facem testul Foundation, primim un raport bioinformatic complet de la bioinformaticieni specializați, care lucrează la Foundation Medicine”.
- Ați menționat „tumor board”-ul genomic, de altfel important pentru lucrul în echipă în folosul pacientului. Testările sunt compensate în Israel, așadar pare că este tabloul perfect. Care sunt provocările majore pentru sistemele de sănătate precum cel românesc în implementarea tehnologiilor NGS?
„Avantajele din domeniu sunt enorme, și totul se mișcă foarte repede: găsești informații noi lunar și dacă nu te pui la curent timp de 6 luni, te găsești în cu totul altă sferă. Așadar lucrurile se mișcă foarte repede și trebuie să ne adaptăm și sistemul de sănătate trebuie să se adapteze la aceste schimbări foarte repede. Așa că una dintre principalele provocări este, evident, bugetul. Termenul toxicitate financiară continuă să apară și nu este o glumă: aceste decese costă și la fel și tratamentele. Dar știm că trebuie să prioritizăm, să facem testele pentru pacienții care au cea mai mare nevoie de ele.
În cancerul pulmonar, îștim că acele tratamente îi pot ajuta în prima linie de tratament și, adesea, nu primim o a doua șansă pentru acești pacienți. În cazul cancerului mamar trebuie să prioritizăm grupul triplu negativ și trebuie să lucrăm la nivel local și să încercăm să avem paneluri care se pot efectua local și reduc costurile. Desigur, nu este la fel de comprehensiv ca a testa paneluri moleculare precum Foundation, dar ne-ar putea oferi răspunsuri. A doua provocare ține de aprobarea medicamentelor.
Dr. Moscovitz a menționat și importanța studiilor clinice:
„Știm că există o mulțime de studii clinice în desfășurare și acest lucru poate ajuta pacienții noștri să aibă acces la diferite medicamente înainte ca ele să fie aprobate de autoritățile de reglementare. Dacă găsim o cale prin care să accelerăm birocrația studiilor clinice în cadrul agențiilor guvernamentale, atunci pacienții pot avea acces la studiile clinice și la terapii. Aceasta este una dintre metode, iar cealaltă este: odată ce medicamentele sunt validate în studiile clinice, iar datele sunt prezentate, să se înceapă deja procesul de rambursare. Este o mulțime de muncă de făcut din partea tuturor, medici, autorități, dar este cu adevărat satisfăcător, deoarece îi putem oferi pacientului terapii mai noi, cu rate de răspuns mari și supraviețuire totală de durată”, a concluzionat Dr. Moscovitz.
Citește și:
- Cei mai importanți markeri genetici în oncologie, clasificați cu ajutorul tehnologiei CRISPR: 600 de gene, ținte terapeutice în 30 de tipuri de cancer
- Actualizarea ghidului NCCN pentru cancerul pulmonar non-microcelular: noile recomandări privind administrarea imunoterapiei
- Pembrolizumab, disponibil în România, în regim compensat, pentru pacienții cu cancer pulmonar metastatic și melanom

