#Rare2030. Planul European pentru Boli Rare, discutat în Parlamentul European. Care sunt recomandările?
În cadrul sesiunii plenare de pe 24 noiembrie, 19 membri ai Parlamentului European au dezbătut abordarea UE cu privire la bolile rare, solicitând Comisiei Europene adoptarea unui Plan de Control al Bolilor Rare până în 2023. Dezbaterea reprezintă o demonstrație de susținere a demersului Rare 2030 Action.
În Uniunea Europeană, o boală este considerată a fi rară dacă afectează mai puțin de o persoană din 2.000. Peste 6.000 de boli rare au fost identificate până în prezent. În total, ele afectează nu mai puțin de 30 de milioane de europeni și peste 300 de milioane de oameni din lumea întreagă. Având în vedere complexitatea diagnosticului și timpul îndelungat care se scurge de la suspiciune până la stabilirea afecțiunii, numărul persoanelor afectate ar putea fi mult mai mare.
Dezbaterea din Parlamentul European are la bază inițiativa Rare 2030 Action, susținută de EURORDIS – rețeaua pacienților cu boli rare din Europa. La rândul său, această inițiativă se bazează pe studiul Rare 2030 – Foresight in Rare Disease Policy, asumat de multiple organizații civile și academice, care face o serie de 8 recomandări pentru îmbunătățirea vieții persoanelor care trăiesc cu o boală rară la nivel european.
- Planuri și strategii europene / naționale, pe termen lung.
- Diagnosticare precoce, mai rapidă, mai precisă.
- Acces la servicii de sănătate de înaltă calitate.
- Îngrijiri integrate și centrate pe persoană.
- Parteneriate cu pacienții.
- Cercetare și dezvoltare inovatoare, pe baza nevoilor semnalate.
- Optimizarea utilizării datelor în favoarea pacienților și societății, cetățenilor.
- Tratamente disponibile, la prețuri accesibile.
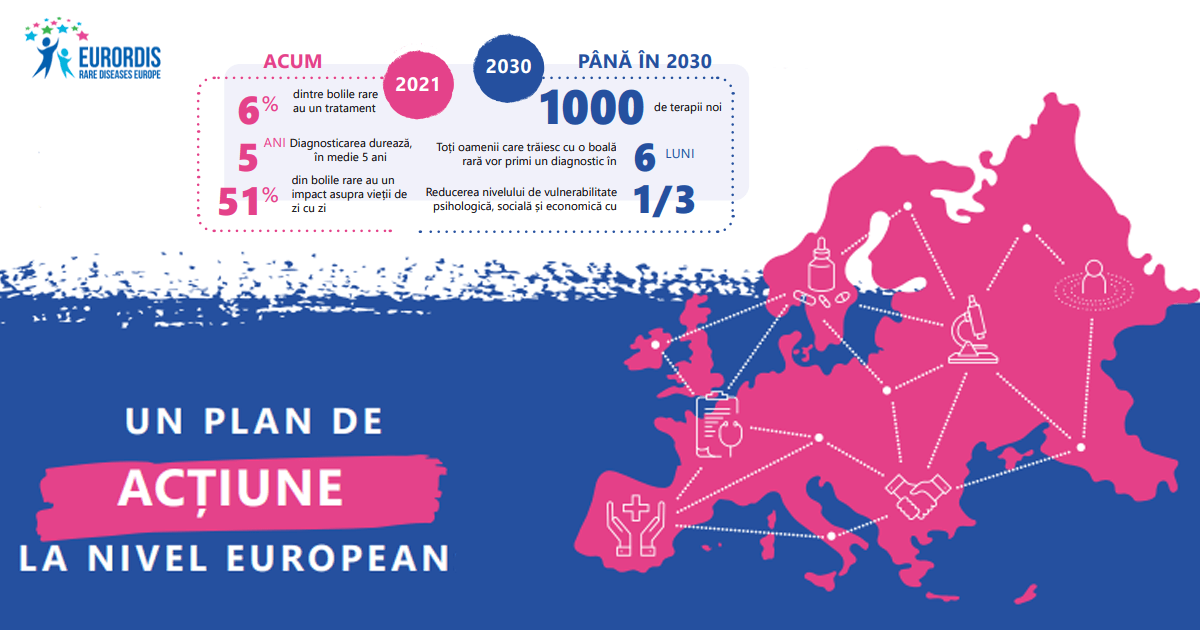
Planul european de acțiune pentru boli rare ar trebui să treacă dincolo de îmbunătățirea accesului pacienților la diagnostic, informații și îngrijire și să reprezinte, de fapt, o nouă strategie colectivă europeană pentru bolile rare, care stabilește obiective generale, priorități și conectează domenii, cum ar fi cercetarea și inovarea în domeniul bolilor rare, cu eficiența sistemelor naționale de sănătate, stimulează cooperarea transfrontalieră și incluziunea socială, respectând în același timp drepturile omului pentru persoanele cu boli rare.
Răspunzând cererii adresate în sesiunea plenară, Ursula von der Leyen, președinta Comisiei Europene, a subliniat acțiunile UE, care au influențat domeniul bolilor rare, din ultimii ani:
„Regulamentul UE pentru medicamente orfane a stimulat în mod clar cercetarea și dezvoltarea de medicamente pentru bolile rare. Dar mai sunt multe de făcut, deoarece 95% dintre bolile rare încă nu beneficiază de tratament, iar medicamentele orfane nu sunt accesibile pacienților în mod egal în toate statele membre.
De aceea, ca parte a Strategiei farmaceutice UE, vom revizui normele actuale pentru a stimula inovarea, în special acolo unde este cea mai mare nevoie de ea, pentru a face medicamentele mai ușor accesibile în întreaga UE. Determinarea de a ne asigura că toți pacienții cu boli rare, inclusiv copiii, au acces la cele mai bune cunoștințe, diagnostic și tratament se află în centrul eforturilor noastre. Rețelele europene de referință sunt esențiale pentru atingerea acestui obiectiv.
La începutul anului viitor, vă voi prezenta o propunere de lansare a unui Spațiu european de date privind sănătatea (European Health Data Space). Lipsa datelor este o provocare crucială pentru bolile rare. (…)
În 2022, vom încheia evaluarea Directivei privind asistența medicală transfrontalieră, inclusiv prevederile acesteia privind cooperarea pentru bolile rare și rețelele europene de referință. Ne va oferi dovezi importante și ne va informa evaluarea cu privire la abordarea actuală a bolilor rare. Două procese suplimentare vor informa acea evaluare: evaluarea celui de-al treilea program de sănătate, care a finanțat acțiuni cheie în domeniul bolilor rare și rezultatele Proiectului Pilot RARE 2030, așa cum a fost propus în această Cameră”.
Citește și:
- Genomics England va lansa un program pilot pentru secvențierea întregului genom (WGS) de la 200 de mii de nou-născuți. Câte boli rare ar putea fi depistate și tratate astfel?
- PREMIERĂ. Secvențierea întregului genom, validată ca test de primă linie pentru diagnosticul bolilor rare în UK. Care sunt beneficiile pentru pacienți și pentru sistemul de sănătate?
- INTERVIU. Dorica Dan, despre accesul la servicii medicale și inovație pentru pacienții cu boli rare în contextul COVID-19

