Redefinirea insuficienței cardiace: cunoașterea genotipului persoanelor care suferă de cardiomiopatii contribuie semnificativ la personalizarea managementului clinic
Insuficiența cardiacă (IC) poate să se dezvolte în urma mai multor tipuri de afecțiuni cardiovasculare, ceea ce a condus, de-a lungul timpului, la ipoteza că diverși stimuli contribuie la un mecanism final comun. În prezent, cunoașterea etiologiei nu influențează direct alegerea tratamentului pentru insuficiența cardiacă, ceea ce se reflectă în povara crescută a IC la nivelul sistemelor de sănătate. Dezvoltarea tehnologiilor de secvențiere de mare capacitate și înaltă rezoluție permite, însă, caracterizarea cauzelor IC din perspectivă moleculară, iar astfel de date ar putea contribui la o abordare personalizată a cazurilor de IC.
Deși există mecanisme comune la persoanele cu cardiomiopatii, care conduc la afecțiunea denumită colectiv insuficiență cardiacă, un nou studiu, publicat în Science, arată importanța înțelegerii profilului genetic individual pentru managementul clinic. Datele obținute prin analiza transcriptomică a peste 880.000 de celule de la nivel miocardic au fost interpretate cu ajutorul algoritmilor de inteligență artificială (AI), demonstrând că mecanismele moleculare și celulare care determină fiecare caz de insuficiență cardiacă sunt puternic influențate de genotip. Nu toate cazurile de cardiomiopatii care evoluează cu insuficiență cardiacă sunt la fel, variantele genetice ale fiecărei persoane determină activarea unor mecanisme particulare care influențează evoluția și răspunsul la tratament.
Rezultatele ar putea schimba modul în care este definită insuficiența cardiacă, subliniază importanța testării genetice și indică noi ținte moleculare ce pot fi explorate pentru identificarea de terapii personalizate.
Cardiomiopatiile sunt boli ale miocardului care conduc la scăderea funcției de pompă și în final la insuficiență cardiacă și adesea au cauză genetică. Cardiomiopatia dilatativă (CMD) este cea mai frecventă cauză de insuficiență cardiacă ce necesită transplant de cord. În ultimii ani s-au descoperit tot mai multe variante genetice care cauzează CMD (peste 60 gene), ceea ce reprezintă o oportunitate pentru evaluarea impactului genotipului asupra mecanismelor fiziopatologice care determină IC.
Pentru realizarea studiului au fost evaluate variante genetice patologice de la nivelul țesutului cardiac la rezoluție de celulă individuală, ceea ce a permis descifrarea mecanismelor prin care variantele respective conduc la disfuncție cardiacă. Cordul uman cuprinde mai multe tipuri de celule, principalele fiind cardiomiocitele (un tip specializat de celulă musculară care generează forța contractilă), fibroblaste (care alcătuiesc țesutul conjuctiv și sunt implicate în procesele fibrotice) și celule musculare netede.
Studiul este parte din Human Cell Atlas Consortium, un proiect care are ca scop caracterizarea tuturor tipurilor de celule din organismul uman. 880.000 de celule individuale de la nivelul miocardului au fost studiate, în cadrul unui consorțiu internațional, cu reprezentanți din 6 țări. Fiecare celulă cardiacă a fost evaluată separat, generându-se o cantitate enormă de date. S-a evaluat compoziția celulară atât la nivelul cordului sănătos, cât și la nivelul cordului patologic, prin secvențierea de tip single-nucleus RNA-sequencing (snRNAseq).
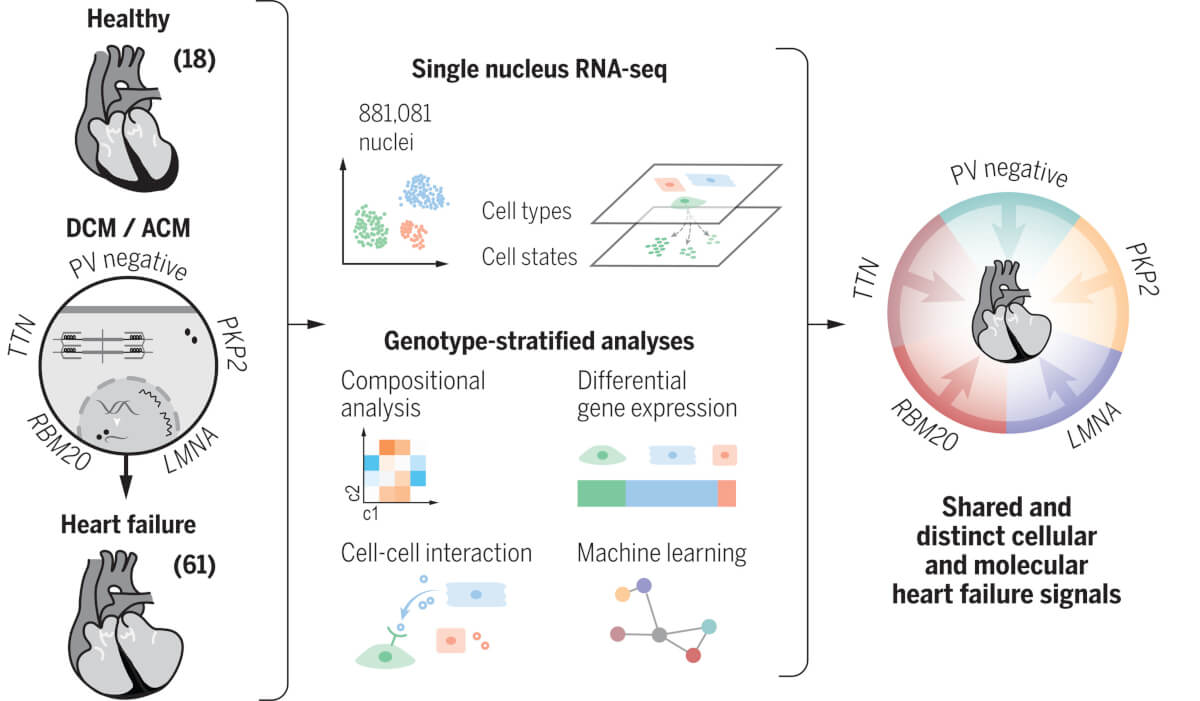
Analiza transcriptomului (setul de molecule de ARN) oferă informații esențiale pentru înțelegerea impactului genelor patologice, arătând dacă genele sunt sau nu active la un moment dat. Până acum nu se putea realiza un astfel de studiu pe țesut cardiac deoarece analiza transcriptomică era dificilă, însă datorită tehnologiilor care permit secvențierea la nivel de celule individuale, poate fi comparată activitatea anumitor tipuri de ARN în fiecare tip de celulă din miocard. Astfel, se poate caracteriza cu acuratețe ce anume se modifică în fiecare celulă pe măsură ce cardiomiopatia progresează. Au fost testate probe de țesut ventricular de la 61 de pacienți cu cardiomiopatie dilatativă de cauză genetică și idiopatică și cardimiopatie aritmogenă, care au fost comparate cu 18 probe de control de la indivizi sănătoși.
Datele obținute prin secvențiere au condus la identificarea a 10 tipuri celulare majore și a 71 de statusuri transcripționale distincte. În cordurile afectate s-a observat o depleție a cardiomiocitelor și creșterea celulelor imune și endoteliale și o activitate modificată a fibroblastelor.
Rezultatele arată că, de exemplu, fibroza care se observă în contextul DCM nu e cauzată de creșterea numărului de fibroblaste în cord, ci de o hiperactivare a fibroblastelor care produc mai mult matrix extracelular. Acest fenomen a fost mai accentuat la pacienții care prezentau mutații la nivelul genei RBM20. Autorii au explicat că rezultatele se corelează cu istoricul pacienților. Cei care au această mutație necesită transplant mult mai devreme decât persoanele cu alte genotipuri.
Ulterior, au fost analizate cazurile care prezentau variante patogene asociate cardiomiopatiei dilatative (LMNA, RBM20, TTN) și cardiomiopatiei aritmogene (PKP2) și probe fără variante patologice pentru a se determina caracteristici moleculare particulare cordurilor afectate. Aceste mutații determină modificarea unor proteine cu funcții diferite la nivelul cordului.
Folosind algoritmi de inteligență artificială s-au căutat diferite tipare care ar putea fi relevante pentru mecanismele acestor boli. Concluzia a fost că deși există căi moleculare comune, diferențele legate de genotip determină căi de semnalizare distincte în fiecare caz, chiar și fazele avansate de boală. Seturile de date și platforma folosite în studiu sunt disponibile public, pentru a încuraja cercetări similare care pot identifica noi ținte terapeutice. În continuare, consorțiul își propune studierea acestor mecanisme și pentru stadiile mai puțin avansate de boală.
Autorii au explicat că acest studiu reprezintă un pas important pentru dezvoltarea de terapii personalizate pentru IC, tratamentul ghidat de genotip ar fi mai eficient și ar conduce la mai puține reacții adverse iar datele pot informa și strategiile de prevenție. De asemenea, studiul ar putea reprezenta un model pentru cercetarea altor boli genetice cardiovasculare.
Bolile cardiovasculare (BCV) reprezintă principala cauză de mortalitate în rândul adulților la nivel european – conduc la 36% din toate decesele la nivel UE, afectând 60 de milioane de persoane. Aproximativ 20% din toate decesele premature (înainte de 65 de ani) în UE sunt cauzate de BCV. Contrar percepției publice, bolile cardiovasculare nu pot fi prevenite întotdeauna prin modificarea stilului de viață. Multe afecțiuni cardiovasculare sunt de cauză genetică, unele fiind ereditare.
În 2020, American Heart Association (AHA) a emis un document de poziție prin care recomandă testarea genetică pentru pacienții diagnosticați cu cardiomiopatii, aritmii, boli vasculare și dislipidemii (hipercolesterolemia familială). A fost publicată și o listă cu 30 de gene acționabile asociate bolilor cardiovasculare. Chiar și la pacienții care au un diagnostic clinic de boală cardiovasculară ereditară, testarea genetică este importantă pentru personalizarea conduitei terapeutice.
Insuficiența cardiacă (IC) este un sindrom complex, ce reunește semne, simptome și etiologii diverse. În 2021, societățile internaționale din domeniul cardiologiei au elaborat un document de consens, în care s-a prezentat prima definiție universală a insuficienței cardiace. Un element important în această definiție este includerea biomarkerilor – care acționează drept variabile clar definite, măsurabile, esențiale în diagnosticul diferențial și în urmărirea evoluției bolii. În mai multe domenii medicale, în special oncologia, biomarkerii au devenit un element central în procesul de diagnostic, stadializare, urmărire și alegere a tratamentului.
Citește și:
- 1 din 3 pacienți din clinicile de cardiologie de zi ar putea beneficia de tratament țintit în urma testării genetice de rutină
- Document de poziție ESC: recomandări pentru implementarea farmacogenomicii în managementul bolilor cardiovasculare
- #BeatCVD. Planul european de luptă împotriva bolilor cardiovasculare: 12 organizații europene și internaționale lansează un apel către CE

