Zolgensma a primit aprobare în Marea Britanie pentru tratamentul pacienților pediatrici cu atrofie musculară spinală de tip 1
Terapia genică Zolgensma (onasemnogene abeparvovec) a primit aprobare în Marea Britanie pentru tratamentul pacienților pediatrici cu atrofie musculară spinală de tip 1, cu vârste de până la 12 luni. Zolgensma, care are un preț raportat la 1,79 milioane de lire sterline, a devenit astfel cel mai scump tratament aprobat vreodată de Institutul Național pentru Excelență în Sănătate și Îngrijire (NICE) și este considerată cea mai scumpă terapie din lume.
În proiectul de recomandare, NICE a decis că, deși terapia genică are un preț extrem de ridicat, utilizarea acesteia este justificată de impactul excepțional pe care îl poate avea asupra acestor copii. Potrivit NHS, acesta va fi disponibil pacienților la un preț echitabil pentru contribuabili, în urma unui acord confidențial.
Pacienții diagnosticați cu AMS de tip 1, netratați, necesită ventilație permanentă înainte de vârsta de 2 ani în peste 90% dintre cazuri. Zolgensma este o terapie cu potențial curativ, administrată o singură dată în viață.
„Acest acord poate schimba viața copiilor cu această boală gravă și viața familiilor lor. Atrofia musculară spinală este principala cauză genetică de deces în rândul copiilor mici, motiv pentru care NHS Anglia a mutat munții din loc pentru a face disponibil acest tratament, în timp ce a negociat cu succes din spatele scenei pentru a asigura un preț echitabil pentru contribuabili” – Sir Simon Stevens, Directorul executiv al NHS Anglia
Acordul încheiat cu Novartis Gene Therapies asigură medicamentul pentru pacienții din cadrul NHS Anglia la un preț redus substanțial. NICE urmează să publice un ghid cu recomandări.
Conform termenilor înțelegerii, copiii care nu se încadrează în prezent în criteriile de recomandare NICE vor fi, de asemenea, eligibili pentru a fi luați în considerare pentru tratament de către o echipă clinică națională multidisciplinară (MDT). Asta înseamnă că 80 de nou-născuți și copii mici din Anglia ar putea beneficia de terapia genică în fiecare an.
Tratamentul necesită o singură administrare intravenoasă, prin care se introduce o copie funcțională a genei SMN1 în organism. Tratamentul cu Zolgensma a determinat rezultate fără precedent în evoluția bolii, în cele două studii care au condus la aprobare. Dacă pentru formele grave de AMS, speranța de viață nu depășea vârsta de 2 ani, cu ajutorul terapiei genice pacienții au reușit să respire fără suportul unui ventilator, să se deplaseze, să vorbească, și la patru ani de la administrarea tratamentului.
NHS întreprinde în prezent un proces riguros de identificare a centrelor de excelență pentru a furniza gama completă de servicii necesare pentru administrarea tratamentului în condiții de siguranță, cu noi servicii specializate în tratarea acestor pacienți în lunile următoare: terapie intensivă pediatrică și o gamă largă de alte expertize clinice, cum ar fi medicină neuromusculară, medicină respiratorie pediatrică, imunologie, boli infecțioase, hepatologie, nefrologie, cardiologie și endocrinologie.
Zolgensma a fost deja aprobată în peste 38 de țări și peste 1.000 de pacienți au beneficiat deja de tratament. În mai 2020, la un an distanță față de aprobarea din partea FDA, Comisia Europeană a emis aprobarea condiționată pentru Zolgensma – indicată pacienților cu mutație bialelică la nivelul genei SMN1 și cu diagnostic clinic de AMS de tip 1 sau până la 3 copii ale genei SMN2. Aprobarea include pacienți pediatrici care au până la 21 de kilograme.
Compania producătoare a activat programul „Day One” odată cu aprobarea în UE, care stabilește un sistem de plată ce permite accesul timpuriu al pacienților la tratament și adaptarea ulterioară la mecanismele de rambursare specifice fiecărei țări.
Ce este atrofia musculară spinală?
Atrofia musculară spinală reprezintă o boală genetică rară caracterizată printr-un deficit al proteinei SMN (survivial motor neuron), care determină distrugerea neuronilor motori și atrofia musculară, ceea ce conduce în formele severe la afectarea unor funcții vitale. Pacienții ajung să nu se poată mișca, nu se pot alimenta corespunzător, nu pot înghiți, au dificultăți de respirație și de vorbire. Peste 60.000 de copii sunt diagnosticați în fiecare an cu această afecțiune.
Proteina SMN este codificată de genele SMN1 și SMN2. Anomalii ale genei SMN1 determină obținerea unei proteine incomplete sau nefuncționale. Acest deficit poate fi parțial compensat de gena SMN2. Numărul genelor SMN2 variază la fiecare persoană, însă cu cât sunt prezente mai multe copii, cu atât se va produce o cantitate mai mare de proteină și boala va avea o formă mai ușoară.
60% dintre persoanele diagnosticate prezintă tipul 1 al AMS. Aceasta este o formă severă, în care simptomele sunt prezente la naștere sau până la vârsta de 6 luni și mai puțin de 10% dintre pacienți supraviețuiesc după vârstă de 2 ani.
În cazul AMS de tip 2, pacienții supraviețuiesc mai mult, iar tipurile 3 și 4 au debut tardiv, nu afectează atât de mult speranța de viață, însă apar grade diferite de slăbiciune musculară.
Date din studiile clinice
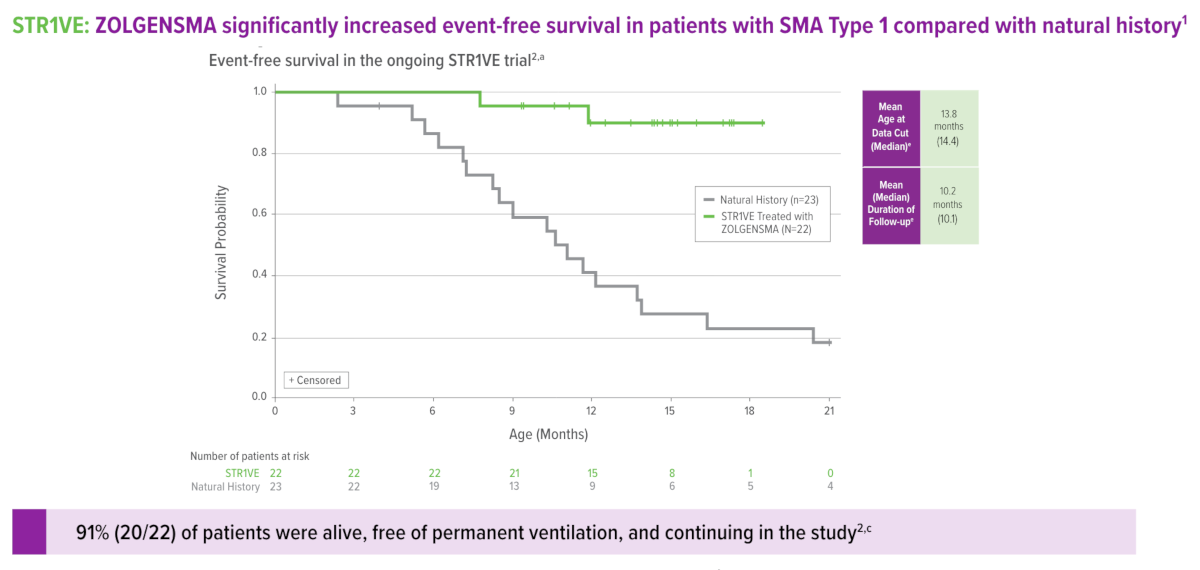
Studiul de fază 3, STR1VE-US, și studiul de fază I, START, au evaluat eficacitatea și siguranța terapiei genice la pacienții simptomatici cu AMS tip 1, cu vârste sub 6 luni la momentul administrării. S-a observat ameliorarea rapidă a funcției motorii, chiar la o lună de la administrare. Rezultatele sunt susținute – pacienții pot sta în șezut fără ajutor, pot merge singuri, funcții care nu ar putea fi niciodată atinse de un pacient cu AMS tip 1 netratat.
Datele intermediare din studiul clinic în fază 3, STR1VE-UE, aflat în curs de desfășurare, sugerează că Zolgensma oferă „beneficii terapeutice semnificative”, inclusiv supraviețuirea fără evenimente adverse, îmbunătățirea rapidă și susținută a funcției motorii, și realizarea achizițiilor motorii, pentru pacienții cu atrofie musculară spinală de tip 1.
Studiul de fază 3, SPR1NT, a evaluat tratamentul cu Zolgensma înainte de instalarea simptomelor, la pacienții cu vârste sub 6 săptămâni, cu deleții bialelice ale genei SMN1, cu 2-3 copii ale genei SMN2. Datele sugerează faptul că pacienții se pot dezvolta normal, dobândind funcțiile motorii conform vârstei și sugerează importanța intervenției precoce.
Cum se poate asigura accesul la cel mai scump tratament din lume?
Zolgensma este considerată o terapie cost-eficientă, având în vedere datele oferite de ICER (Institute for Clinical and Economic Review). Conform declarației oficiale din partea Novartis, costurile pentru Zolgensma ar reprezenta:
- Cu 50% mai puțin decât costurile totale asociate îngrijirilor cronice ale unui pacient timp de 10 ani cu tratamentul actual;
- Cu 50% mai puțin decât costurile pe 10 ani pentru boli genetice foarte rare în populația pediatrică;
- Cu 50% mai puțin decât limita stabilită de ICER pentru cost-eficiența medicamentelor foarte rare.
Prețul inițial menționat de Novartis a fost de aproximativ 5 milioane de dolari având în vedere beneficiile aduse de acest tratament cu potențial curativ administrat o singură dată. Singurul tratament disponibil până acum pentru AMS, Spinraza, a fost lansat pe piață cu un preț de asemenea ridicat, de peste 300.000 de dolari anual, aceasta fiind însă o terapie care se administrează pe parcursul întregii vieți.
ICER a realizat o analiză de cost-eficiență și a estimat că prețul justificat pentru Zolgensma nu ar trebui să depășească 1,5 milioane de dolari. Cu toate acestea, având în vedere noile date legate de eficacitate, la pacienții la care simptomele nu s-au instalat, președintele ICER a declarat că terapia este cost-eficientă și la o sumă de 2,1 milioane de dolari.

Alte opțiuni terapeutice pentru AMS
Zolgensma este a doua terapie pentru AMS aprobată în UK, după Spinraza (aprobată în mai 2019).
Spinraza (nusinersen) a fost prima terapie modificatoare de boală aprobată în 2016 de FDA pentru tipurile 1-3 de AMS. Acesta este un tip de tratament cu rol în reglarea expresiei genice. Este o oligonucleotidă antisens sintetică, ce se leagă de ARN și poate determina obținerea unei proteine funcționale și de lungime normală. Spinraza crește supraviețuirea și ameliorează funcția motorie, însă NU reprezintă un tratament curativ.
Tratamentul presupune injecții administrate intratecal (în lichidul cefalorahidian care înconjoară măduva spinării) pentru tot restul vieții pacienților. Prețul ajunge la 750.000 dolari în primul an și 375.000 ulterior.
Risdiplam este al treilea tratament pentru AMS aprobat de FDA vara trecută și are potențialul de a extinde accesul la tratament pentru pacienții cu AMS. În timp ce celelalte două terapii aprobate – nusinersen (Spinraza) și onasemnogene abeparvovec (Zolgensma) – au condus la îmbunătățiri ale supraviețuirii și funcției motorii, acestea sunt administrate intratecal, respectiv intravenos, în timp ce risdiplamul este o terapie orală.
La începutul anului 2021, Comitetul pentru Medicamente de Uz Uman (CHMP) al Agenției Europene a Medicamentului (EMA) a recomandat aprobarea Evrysdi (risdiplam) și este așteptată în curând aprobarea din partea agenției europene. Deoarece Marea Britanie a părăsit Uniunea Europeană în cursul evaluării EMA a risdiplam, Roche va prezenta risdiplam pentru examinarea autorizației de introducere pe piață de către Agenția de reglementare a medicamentelor și produselor medicale (MHRA) în cadrul procedurii de dependență a deciziei Comisiei Europene în următoarele săptămâni. Data autorizației de introducere pe piață din partea EMA se va aplica numai Irlandei de Nord.
În prezent nu există studii care să compare diferitele tratamente aprobate pentru AMS. Fiecare pacient și familie ar trebui să discute, în colaborare cu furnizorul de asistență medicală, despre tratamentele disponibile și să ia decizia care este cea mai bună pentru ei.
Citește și:
- Noi recomandări FDA pentru accelerarea dezvoltării de terapii personalizate pentru bolile rare
- FDA aprobă casimersen pentru distrofia musculară Duchenne, o nouă terapie țintită care funcționează prin mecanismul exon skipping
- FDA aprobă primul tratament pentru progeria, o boală genetică pediatrică rară, care determină îmbătrânire prematură

