FDA aprobă casimersen pentru distrofia musculară Duchenne, o nouă terapie țintită care funcționează prin mecanismul exon skipping
FDA (Administrația Alimentelor și Medicamentelor din Statele Unite) a aprobat casimersen (oligonucleotidă antisens cu denumire comercială Amondys 45), pentru tratamentul pacienților cu distrofie musculară Duchenne (DMD) care prezintă mutația genei DMD, ce poate fi adresată prin tehnica exon 45 skipping. Aprobarea s-a bazat pe observarea efectului de creștere al producției de distrofină (proteină care ajută la menținerea intactă a celulelor musculare) la pacienții tratați cu casimersen. Acesta este primul tratament țintit aprobat de FDA pentru pacienții cu mutație la nivelul exonului 45, care reprezintă 8% din pacienții cu DMD.
„Dezvoltarea medicamentelor concepute pentru pacienții cu mutații specifice este o parte critică a medicinei personalizate”, a declarat Dr. Eric Bastings, director adjunct al Biroului de Neuroștiințe din Centrul FDA pentru Evaluarea și Cercetarea Medicamentelor.
Casimersen a fost evaluat în studiul clinic ESSENCE, dublu-orb, controlat placebo, în care 43 de pacienți au fost împărțiți aleator pentru a primi intravenos o dată pe săptămână fie casimersen, fie placebo. Toți pacienții au fost de sex masculin, cu vârsta cuprinsă între 7 și 20 de ani, și au prezentat mutație confirmată a genei DMD care poate fi supusă tehnicii exon skipping 45. Pacienții cărora li s-a administrat casimersen au înregistrat o creștere semnificativ mai mare a nivelurilor de distrofină în săptămâna 48 de tratament, față de nivelul inițial și comparativ cu cei care au primit placebo.
Principalele constatări ale analizei intermediare, după 48 de săptămâni, au fost următoarele:
- Nivelurile medii de distrofină au crescut semnificativ statistic cu 1,7% în grupul de tratament cu Amondys 45, comparativ cu 0,9% în grupul placebo.
- Dintr-un eșantion de 22 de pacienți cu DMD care au primit Amondys 45, toți au arătat o creștere a nivelurilor de ARNm în care exonul 45 a fost omis, în comparație cu nivelurile inițiale (rată de răspuns de 100%). Mai mult, a existat o corelație pozitivă și semnificativă statistic între omiterea exonului 45 (exon skipping) și producția de distrofină.

Cele mai frecvente efecte secundare observate la pacienții cu DMD tratați cu casimersen au fost infecții ale tractului respirator superior, tuse, febră, cefalee, dureri articulare și odinofagie. Deși în studiile clinice nu s-a observat toxicitatea renală a tratamentului, aceasta a fost observată în studiile non-clinice, unde a fost raportată după administrarea unor oligonucleotide antisens. Așadar, funcția renală trebuie monitorizată la pacienții care primesc casimersen.
FDA a concluzionat că datele prezentate au demonstrat o creștere a producției de distrofină, care este în mod rezonabil probabil să prezică beneficiile clinice la pacienții cu distrofie musculară Duchenne care au o mutație confirmată a genei DMD la nivelul exonului 45, susceptibilă tehnicii exon skipping. Un beneficiu clinic al medicamentului, inclusiv îmbunătățirea funcției motorii, nu a fost încă stabilit. În luarea acestei decizii, FDA a luat în considerare riscurile potențiale asociate medicamentului, natura amenințătoare de viață și debilitantă a bolii, precum și lipsa altei terapii disponibile pentru această categorie de pacienți cu DMD.
Amondys 45 (casimersen) a fost aprobat folosind calea de aprobare accelerată, în cadrul căreia FDA poate aproba medicamente pentru afecțiuni grave în care există o nevoie medicală nesatisfăcută, iar medicamentul în cauză are efecte despre care se poate presupune, în mod rezonabil, că se corelează cu un beneficiu clinic pentru pacienți. Sunt necesare în continuare studii suplimentare pentru a verifica și descrie beneficiile clinice anticipate ale casimersen. În prezent, compania producătoare desfășoară un studiu multicentric, dublu-orb, controlat placebo, conceput pentru a evalua siguranța și eficacitatea pe termen lung a Amondys 45 și Vyondys 53 la 260 de pacienți cu DMD în regim ambulatoriu (rezultatele sunt așteptate în anul 2026).
FDA a acordat casimersen statut Fast Track și Priority Review. Amondys 45 a primit, de asemenea, denumirea de medicament orfan, care oferă stimulente pentru a ajuta și a încuraja dezvoltarea de medicamente pentru bolile rare.
Rolul terapiilor țintite în distrofia musculară Duchenne
Distrofia musculară Duchenne este cea mai frecventă formă de distrofie musculară, însă este o boală genetică rară care constă în deteriorarea progresivă a musculaturii scheletice și slăbiciune musculară. Simptomele apar din primii ani de viață (în special în jurul vârstei de 3-5 ani), având evoluție progresivă, iar boala se poate agrava prin afectarea musculaturii cardiace și respiratorii, ceea ce poate conduce la deces. Deoarece defectul genetic cauzator se situează la nivelul cromozomului X, această boală afectează băieții (cu o incidență de 1:3.600 la nivel mondial), și, extrem de rar, persoanele de sex feminin.
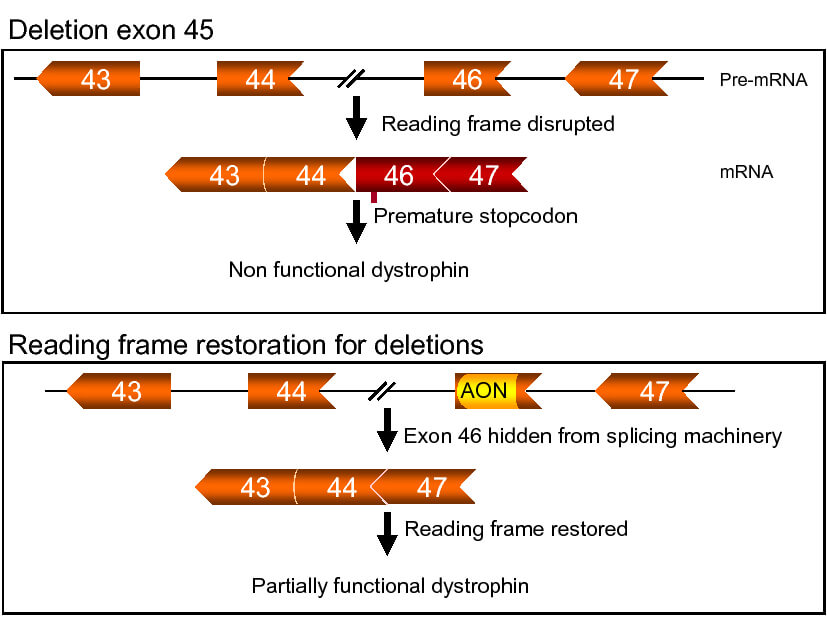
Mecanismul patogenic este absența proteinei numită distrofină, cu rol esențial în funcționarea și structura normală a celulei musculare striate. Gena care codifică structura proteinei este cea mai lungă din genomul uman, fiind formată din 79 de exoni care stau la baza proteinei (exonul reprezentând unitatea de bază a ADN-ului, care transcrie succesiuni de aminoacizi în cadrul proteinelor). Distrofia Duchenne poate fi cauzată de lipsa anumitor exoni plasați în regiuni cheie ale genei; în lipsa acestora, producerea proteinei este întreruptă prematur și rezultă un lanț de aminoacizi mult prea scurt, nefuncțional.
Având în vedere mecanismul genetic particular prin care apare distrofia Duchenne, o clasă terapeutică dezvoltată în ultimii ani s-a dovedit eficientă în controlul evoluției bolii: oligonucleotidele antisens. În procesul de producție al proteinei, exonii sunt transcriși, unul după altul, în succesiunea normală de aminoacizi. Oligonucleotidele antisens acționează prin legarea de exonul în discuție (în cazul casimersen, exonul 45 al distrofinei), împiedicând transcrierea acestuia în proteina finală. În cazul în care distrofia Duchenne este cauzată de lipsa exonilor aflați anterior de exonul 45, inhibarea transcrierii exonului 45 atenuează efectul nociv al acestei lipse: în loc ca proteina să nu mai fie produsă deloc, transcrierea lanțului de exoni este finalizată, rezultând o proteină mai scurtă, însă parțial funcțională.
Alte oligonucleotide antisens sunt deja aprobate în SUA pentru tratamentul distrofiei musculare Duchenne:
- eteplirsen, care acționează prin exon 51 skipping;
- golodirsen și viltolarsen (acționează prin exon 53 skipping).
Niciuna dintre aceste molecule nu este aprobată de către EMA. Pacienții din UE pot beneficia, totuși, de tratament cu ataluren, care acționează asupra ribozomilor (organitele intracelulare la nivelul cărora ARN-ul este transcris în proteine) și facilitează transcrierea distrofinei, în ciuda defectelor genetice.
Citește și:
- FDA aprobă viltolarsen, a doua terapie țintită pentru pacienții cu distrofie musculară Duchenne, care acționează prin exon 53 skipping
- Progrese în managementul distrofiei musculare Duchenne: FDA aprobă primul test de screening pentru nou-născuți și o nouă terapie țintită
- Noi recomandări FDA pentru accelerarea dezvoltării de terapii personalizate pentru bolile rare

