Alzheimer, boala cu o rată de eșec de 99% în studiile clinice care evaluează tratamente. Care sunt provocările științifice și etice?
Boala Alzheimer (BA) se numără printre afecțiunile neurodegenerative ce implică un grad considerabil de provocări din punct de vedere clinic și terapeutic. Progresele științifice înregistrate în ultimii 20 de ani continuă să evidențieze dificultăți majore în deslușirea substratului biologic al bolii și în descoperirea unor tratamente inovatoare care să încetinească declinul cognitiv. Domeniul BA rămâne plin de necunoscute și controverse, iar date științifice recente contestă modelul actual al afecțiunii.
De ce nu a fost încă descoperit un tratament?
În ultimii 20 de ani, în ciuda investițiilor financiare și intelectuale, studiile clinice umane care evaluează tratamente pentru boala Alzheimer au avut o rată de eșec de 99%. Deși unele studii raportează inițial rezultate promițătoare în urma cercetărilor in vitro sau pe modele animale, acestea nu sunt obținute și în studiile cu subiecți umani. Decoperirea unui medicament eficient pentru BA se lovește de două mari provocări: necunoașterea suficientă a substratului biologic al afecțiunii și faptul că moleculele dezvoltate trebuie să treacă de bariera hemato-encefalică.
Spre exemplu, ipoteza plăcilor de amiloid nu explică în totalitate dacă toate tipurile de amiloid sunt toxice sau de ce boala progresează în mod diferit de la un pacient la altul. Totodată, BA este dificil de diagnosticat din cauza debutului insidios caracteristic patologiei, ceea ce amână momentul prescrierii unui tratament. Pacienții manifestă de obicei simptome pe parcursul mai multor ani înainte de diagnostic, timp în care creierul deja suferă modificări neurodegenerative.
În mod tradițional, medicamentele utilizate în cazul bolii Alzheimer tratează patologia din punct de vedere simptomatic, nefiind capabile să încetinească progresia debilitantă a afecțiunii. Tocmai cercetările extinse din sfera modificărilor neurobiologice survenite în BA au contribuit la schimbarea paradigmei în cercetarea și dezvoltarea terapiilor inovatoare precum anticorpii monoclonali (printre care aducanumab și donanemab). Cele două imunoterapii au fost concepute pentru a se lega de plăcile de amiloid intracerebrale, îndepărtându-le.
În ciuda unor opinii divergente ale experților în ceea ce privește eficacitatea aducanumab, în urmă cu peste un an, Food and Drug Administration (FDA) a aprobat aducanumab pentru tratamentul bolii Alzheimer prin calea de aprobare accelerată, mizând pe capacitatea medicamentului de a reduce plăcile de amiloid. Se așteaptă ca acest lucru să conducă la o încetinire a declinului cognitiv și în practică, odată administrat pacienților cu BA, însă acest beneficiu clinic așteptat trebuie să fie confirmat printr-un studiu post-aprobare. În Europa, Agenția Europeană a Medicamentului (EMA) a respins solicitarea de punere pe piață pentru aducanumab, considerând că beneficiile terapiei nu depășesc riscurile asociate acesteia. EMA este de părere că datele actuale nu demonstrează eficacitatea imunoterapiei în tratarea pacienților cu BA deoarece legătura dintre reducerea plăcilor de beta-amiloid de la nivel cerebral și beneficiile clinice nu a fost stabilită. În ciuda dezbaterilor intense pe seama eficacității și a siguranței anticorpului monoclonal, autoritățile de reglementare americane și cele europene abordează diferit decizia de aprobare a medicamentului, posibil și din cauza necesității unei variante terapeutice, dar și a finanțărilor considerabile oferite pentru cercetarea tratamentelor care țintesc plăcile de amiloid.
Disputele referitoare la legătura dintre reducerea plăcilor de amiloid și eficacitatea în încetinirea declinului cognitiv la pacienții cu BA au fost readuse în prim-plan printr-un posibil caz de abatere academică. În 2006, autorii unuia dintre cele mai citate studii din domeniul BA argumentau faptul că oligomerul Aβ*56 contribuie la deficitele cognitive manifestate de pacienții cu boală Alzheimer. Rezultatele studiului bazat pe un model animal au stat la baza multor cercetări ulterioare, însă analiza imaginilor incluse în publicația originală indică semne de alterare a datelor științifice. Aceste alegații sunt investigate în prezent de către Department of Health and Human Services Office of Research Integrity.
Dacă se dovedesc a fi adevărate, acest lucru ar putea însemna că rolul plăcilor de amiloid în deteriorarea cognitivă s-ar putea să nu fie la fel de semnificativ precum sugerează publicația din 2006. Este important de notat faptul că nu este contestată implicarea plăcilor de amiloid în BA, ci mai degrabă măsura în care depunerea lor la nivel cerebral poate explica manifestările afecțiunii neurocognitive. Deși există riscul ca acest caz să submineze încrederea publicului în știință, el demonstrează tocmai contrariul: faptul că integritatea și acuratețea cercetărilor medicale sunt verificabile și pot fi rectificate atunci când dovezile o impun. Totodată confirmă nevoia de publicare și a rezultatelor negative, ce ar putea facilita descoperirea rezultatelor care nu pot fi reproduse.
Parcursul cercetărilor din domeniul BA sugerează faptul că aceasta ar putea reprezenta mai degrabă o colecție de patologii cu cauze biologice diferite și implicit tratamente potențial distincte. Tocmai diversitatea simptomatologiei și a evoluției clinice ale BA susțin această idee. Iar în ceea ce privește tratamentul BA, este tot mai evidentă nevoia unei abordări complexe, multilaterale, în detrimentul modelelor de tipul „totul sau nimic”.
Ipotezele biologice ale bolii Alzheimer și posibili biomarkeri
Deși încă nu se cunosc cu exactitate cauzele apariției bolii Alzheimer, multiplii factori de risc sunt citați ca fiind implicați în etiopatogenia afecțiunii, printre care vârsta înaintată, diverși factori genetici, precum și factori ce țin de stilul de viață sau de mediul înconjurător. În prezent, boala Alzheimer continuă să fie diagnosticată pe baza tabloului clinic, iar rolul investigațiilor suplimentare este de confirmare a diagnosticului, acestea fiind utilizate cu un grad considerabil de variabilitate între diferite clinici la nivel global.
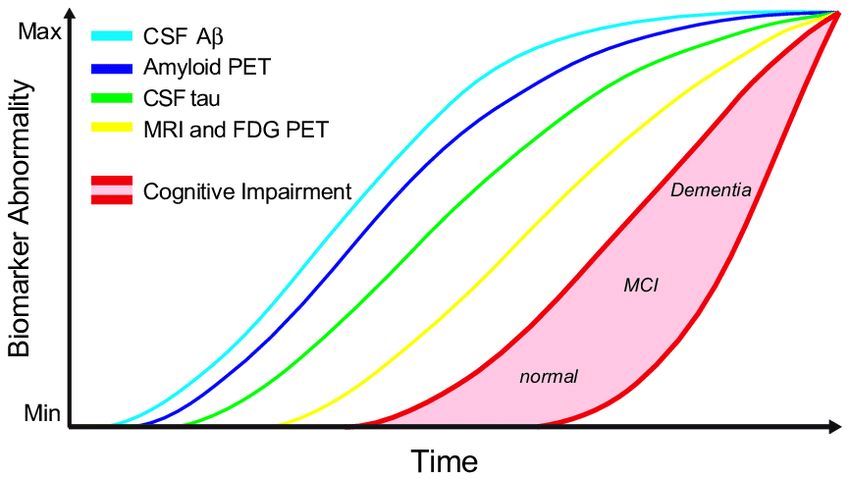
Cele mai multe cercetări din domeniul BA s-au bazat pe ipoteza plăcilor de amiloid care conduc la moarte neuronală. Aceasta explică afecțiunea prin depunerea peptidelor de tip beta-amiloid (Aß) în țesutul neuronal, formând plăcile de amiloid ce pot conduce la disfuncții și pierderi neuronale ireversibile. În concordanță cu progresul dovezilor științifice, oamenii de știință de la National Institute on Aging și Alzheimer’ s Association au propus o nouă definiție pentru BA în anul 2018. Aceasta presupune renunțarea la procesul diagnostic bazat pe manifestările clinice și redefinirea BA în funcție de modificările biologice suferite la nivel cerebral, utilizând mai mulți biomarkeri. Schema astfel propusă grupează biomarkerii în trei categorii – AT(N)(C):
- A – plăcile de amiloid Aβ (observate prin imagistică PET sau prin determinare din LCR);
- T – proteina tau (determinată fie din LCR, fie prin PET);
- N – leziunea neuronală sau procesul neurodegenerativ (identificate prin IRM, PET sau măsurarea proteinei tau totală din LCR);
- C – disfuncții cognitive.
În ultimele două decenii, cercetarea terapiilor pentru BA a întâmpinat multiple dificultăți și doar un singur tratament a fost aprobat în Statele Unite, în ciuda unor controverse. Printre limitările cercetării din domeniul BA se numără și criteriile de înrolare a pacienților (majoritatea studiilor includ pacienții deja clinic simptomatici) și faptul că majoritatea tratamentelor au avut ca țintă îndepărtarea plăcilor de amiloid din stadiile foarte avansate de boală. Studierea bolilor neurodegenerative prin prisma biomarkerilor ar putea determina o mai bună înțelegere a evoluției naturale a bolii, facilitând totodată desfășurarea de studii clinice multicentrice pentru dezvoltarea unor medicamente inovatoare.
Noua definiție reflectă noțiunea de „cognitive continuum” și renunță la modelul anterior în care BA era împărțită în stadiu preclinic, tulburare cognitivă ușoară (MCI) și demență.
Factori genetici implicați în boala Alzheimer
Unul dintre cei mai documentați factori genetici de risc pentru boala Alzheimer este varianta ε4 a genei APOE (apolipoproteina E). Rezultatele unui studiu efectuat pe culturi celulare sugerează faptul că anumite perturbări moleculare la nivelul metabolismului lipidic pot contribui la riscul de boală asociat genotipului APOE4. Cercetătorii au descoperit faptul că APOE4 perturbă capacitatea microgliei de a metaboliza lipidele și împiedică eliminarea lipidelor de către acest tip de celule, efecte ce conduc la diminuarea excitabilității neuronale și la inflamație locală. Deși studiul oferă informații biologice valoroase în ceea ce privește legătura dintre gena APOE4 și riscul de demență, rezultatele nu pot fi extrapolate la ceea ce se întâmplă în realitate în creierul uman, bazându-se pe date obținute din culturi celulare.
Studiile de asociere la nivelul întregului genom (GWAS – genome-wide association studies) au permis extinderea cunoștințelor din sfera factorilor de risc genetic pentru boala Alzheimer. Șapte locusuri de risc pentru BA nedepistate de cercetările anterioare, au fost identificate printr-unul dintre cele mai ample studii GWAS, care a inclus peste 1 milion de persoane. Genele depistate au rol în agregarea amiloidă și tau, catabolismul plăcilor de amiloid, recrutarea celulelor imune și funcția celulelor gliale. Totodată, rezultatele studiului sugerează faptul că genele de risc sunt cel mai probabil exprimate în microglie.
Un alt studiu GWAS mai recent a extins cunoştinţele actuale despre fiziopatologia demențelor, reușind să descopere 75 de locusuri de risc pentru BA și alte forme de demențe asociate, dintre care 42 nedepistate de investigații genomice anterioare. Cele mai semnificative seturi de gene identificate au legătură cu proteinele amiloid și tau, lipide, endocitoză și sistemul imunitar (inclusiv macrofage și microglia), similar cu dovezile științifice raportate anterior. Cercetătorii au generat și scoruri de risc genetic pentru demențele de tip BA pe baza variantelor genetice identificate. Dezvoltarea capacității de predicție a riscului genetic de progresie către boala Alzheimer ar putea contribui la translatarea genomicii în potențiale măsuri preventive sau în personalizarea asistenței medicale oferite persoanelor la risc.
Un alt tip de biomarker: soluții digitale pentru screening-ul bolii Alzheimer
Utilizând tehnologia machine learning (învățare automată), cercetătorii de la Imperial College London au dezvoltat un model predictiv bazat pe imagistica de tip RM (rezonanță magnetică), capabil să detecteze boala Alzheimer cu un grad înalt de acuratețe. Modelul a permis identificarea unui biomarker predictiv (Alzheimer’s Predictive Vector, ApV) pentru fiecare pacient, pe baza căruia algoritmul a putut discrimina între persoanele cu BA și cele fără această patologie în 98% din cazuri. Tehnologia a putut diferenția și stadiile bolii Alzheimer cu precizie destul de mare (79%). Astfel, studiul propune o abordare diagnostică nesupraveghată, bazată pe biomarkeri imagistici RM, pentru depistarea caracteristicilor biologice ale bolii Alzheimer.
De asemenea, o aplicație mobilă care scanează pupilele umane pentru a căuta semne precoce ale afecțiunilor neurocognitive precum boala Alzheimer a fost dezvoltată de o echipă de cercetători de la Universitatea din California San Diego. Tehnologia se bazează pe studii ce sugerează posibilitatea ca răspunsul pupilelor în timpul unor sarcini cognitive să reprezinte un potențial biomarker pentru predicția riscului de tulburare cognitivă ușoară (MCI) sau de boală Alzheimer. Aflat încă în proces de cercetare și dezvoltare, instrumentul digital a demonstrat deja măsurători similare cu cele obținute de un pupilometru utilizat în clinică sau în laboratoare de cercetare în cadrul unui studiu.
Cercetătorii intenționează să continue testarea tehnologiei ca posibil instrument de screening al riscului pentru boala Alzheimer la adulții în vârstă diagnosticați cu MCI, însă evaluări suplimentare sunt necesare pentru a putea înțelege rolul pupilometriei în predicția riscului de BA. Așadar, mai mulți posibili biomarkeri pentru BA sunt în continuare investigați, explorând o paletă largă de căi biologice prin multiple tehnologii, de la analiza LCR și modalități imagistice la testări genetice și pupilometrie. Elucidarea substratului biologic al BA este esențial pentru cercetarea și dezvoltarea de soluții clinice eficiente, mai ales în contextul creșterii sepranței de viață și implicit a incidenței cazurilor de demență. Cu toate acestea, rămân necesare investigații suplimentare pentru a putea stabili gradul de convergență și de reproducere a dovezilor obținute din mai multe planuri, ce ar putea confirma sau infirma eficacitatea biomarkerilor în diagnosticarea BA.

Citește și:
- O nouă definiție a bolii Alzheimer, bazată pe biomarkeri și nu pe manifestările clinice
- Trei noi teste imunologice pentru diagnosticarea bolii Alzheimer, disponibile în România
- STUDIU. Tulburările cognitive din boala Alzheimer, asociate cu disfuncția unor proteine implicate în metabolismul glucidic

