FDA aprobă nivolumab+ipilimumab, prima dublă imunoterapie pentru pacienții cu carcinom hepatocelular, tratați în prealabil cu sorafenib
Opdivo (nivolumab) + Yervoy (ipilimumab) reprezintă prima imunoterapie dublă aprobată de FDA pentru carcinomului hepatocelular (HCC) tratat în prealabil cu Nexavar (sorafenib). Combinația este acum aprobată pentru tratarea a patru tipuri de cancer în Statele Unite, primele trei fiind melanomul, cancerul renal și colorectal.
Aprobarea se bazează pe rezultatele studiului de fază 1/2 CheckMate-040 în care combinația Opdivo + Yervoy a condus la rate globale de supraviețuire în populația analizată de până la 33%, urmând ca studiile de fază 3 și 4 să confirme beneficiile acestui tratament și să confirme aprobarea actuală.
„Carcinomul hepatocelular reprezintă o boală agresivă ce necesită abordări diferite de tratament. Rata de răspuns la tratament, observată în trialul CheckMate-040 în cazul asocierii Opdivo+Yervoy, evidențiază utilitatea terapiei imunologice duale în tratarea pacienților cu cancer” – a declarat dr. Anthony B. El-Khoueiry, USC Norris Comprehensive Cancer Center.

Studiul CheckMate-040
În cadrul studiul CheckMate-040 de fază 1/2 au fost înrolați un număr de 49 de pacienți cu carcinom hepatocelular (HCC) tratați în prealabil cu sorafenib, în cazul cărora patologia a avansat sau au devenit intoleranți la acest tratament. După o urmărire de minim 28 de luni, s-au observat următoarele rezultate:
- 35 % dintre pacienți au răspuns la tratamentul cu Opdivo + Yervoy;
- 12 % au avut un raspuns complet la tratament;
- 22 % au avut un răspuns parțial la tratament.
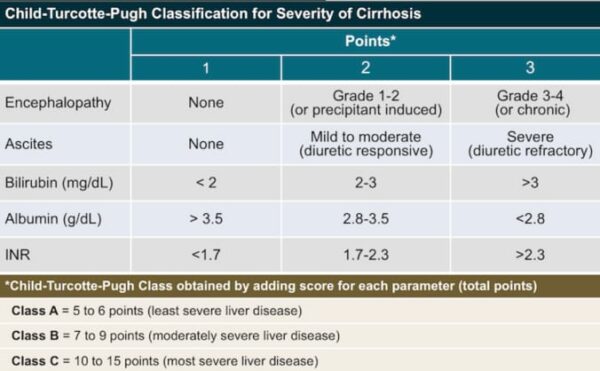
Criteriile de eligibilitate pentru includerea în studiu au fost: confirmarea histologică a HCC și întrunirea criteriilor pentru încadrarea în clasa A de ciroză, conform scorului Child-Pugh. Au fost excluși pacienții cu boli autoimune, metastaze cerebrale, HCC fibrolamelar, colangiocarcinom mixt, istoric de encefalopatie hepatică, infecție cu HIV sau infecție active cu HVB, HVC, HVD.
Pacienților li s-a administrat la fiecare trei săptămâni patru doze de Opdivo 1 mg/kg și Yervoy 3 mg/kg, intravenos. La acestea s-a adăugat o doză de Opdivo 240 mg la fiecare două săptămâni, până în momentul în care s-a înregistrat o toxicitate maxim tolerată sau progresia bolii. În urma studiului au fost evaluate răspunsul complet la tratament, răspunsul parțial la tratament, durata de răspuns la terapie.
Reacții adverse notabile au fost identificate la 59% dintre pacienți. Tratamentul a fost întrerupt în cazul a 29% din pacienți și amânat în cazul a 65% dintre pacienții care prezentau reacții adverse intolerabile. Printre reacțiile adverse se numară: febra, diareea, hiponatremia, anemia, creșterea valorilor AST (enzimă ce denotă afectare hepatică), ascită.
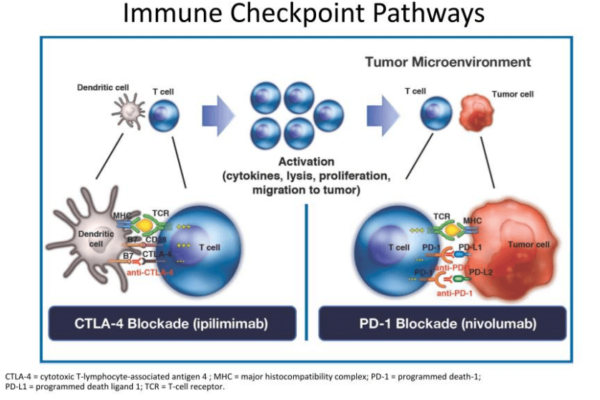
Opdivo + Yervoy este singura dublă imunoterapie aprobată de FDA pentru tratamentul carcinomului hepatocelular. Terapia se bazează pe un mecanism de acțiune sinergic, care vizează două puncte de control imunologic distincte (nivolumab fiind anticorp anti-PD-1 și ipilimumab anticorp anti-CTLA-4) și care funcționează complementar în a permite celulelor imunitare să țintească în mod specific tumora.
Hospital Vall d’Hebrón, Barcelona, Abordaje Multidisciplinar del Cancer XI
,,Recunoaștem că există o nevoie critică de a oferi pacienților cu forme agresive de cancer, cum ar fi HCC, noi opțiuni de tratament care pot furniza răspunsuri semnificative din punct de vedere clinic, și în cele din urmă, să determine rezultate de durată,”- a declarat Adam Lenkowsky, director general Bristol Myers Squibb.
Lista completă de indicații FDA ale combinației terapeutice Opdivo (nivolumab)+ Yervoy (ipilimumab)
- Melanom metastatic nerezecabil;
- Carcinom renal avansat netratat în antecedente, la pacienții care prezintă risc scăzut sau intermediar;
- Cancer colorectal metastatic care a progresat în urma tratamentului cu o fluoropirimidină, oxaliplatină și irinotecan, în cazul pacienților pediatrici cu vârsta de peste 12 ani, cu instabilitate microsatelitară mare (MSI-H);
- Carcinom hepatocelular tratați în prealabil cu sorafenib.
Pentru ultimele doua indicații procesul de aprobare continuă, urmând ca beneficiile să fie confirmate de studiile clinice.
Citește și:
- #ASCO19. Imunoterapia cu nivolumab și ipilimumab aduce beneficii pe termen lung în melanomul avansat
- #ESMO19. Combinația nivolumab și ipilimumab crește supraviețuirea globală în prima linie de tratament a cancerului pulmonar non-microcelular
- Tratamentul cu nivolumab determină rate de supraviețuire superioare la 5 ani în cancerul pulmonar non-microcelular, comparativ cu chimioterapia

