Esențial COVID-19. Cele mai importante știri ale săptămânii 22-28 februarie 2021: FDA a autorizat vaccinul Johnson & Johnson împotriva COVID-19 pentru utilizare de urgență în SUA
Accesează Esențial Covid-19

Cele mai importante știri ale săptămânii 22-28 februarie 2021:
FDA a autorizat vaccinul Johnson & Johnson împotriva COVID-19 pentru utilizare de urgență în SUA
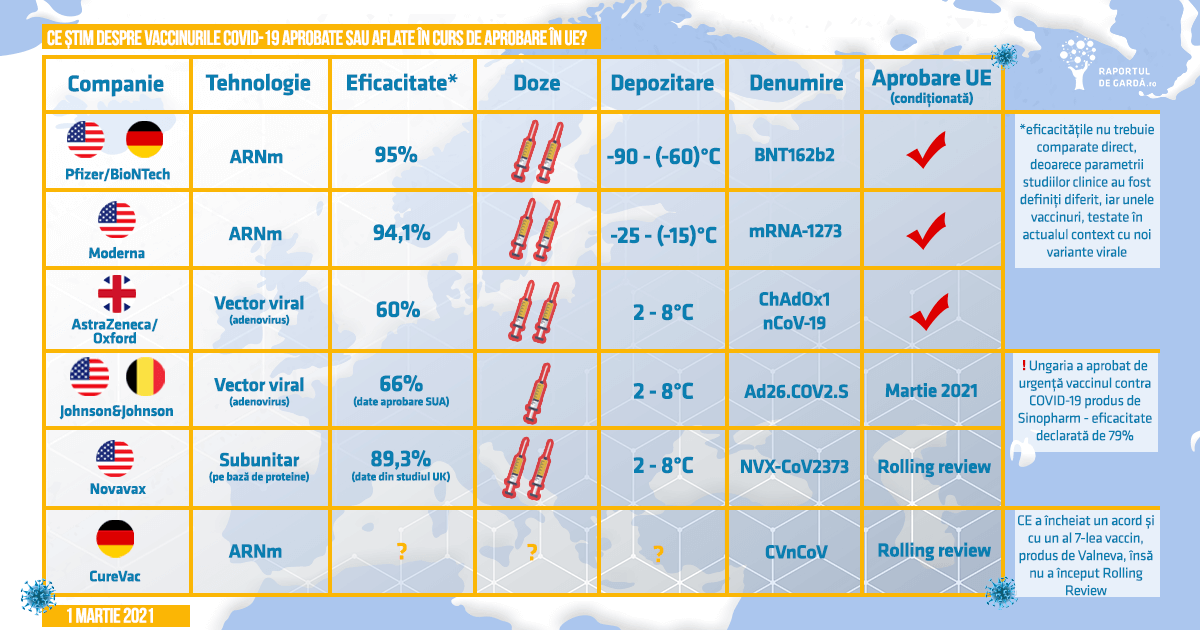
Această aprobare de urgență pune la dispoziția Statelor Unite al treilea vaccin împotriva COVID-19 (mai sunt aprobate Pfizer și Moderna). Spre deosebire de primele două aprobate, vaccinul J&J se recomandă a fi administrat într-o singură doză (persoanelor peste 18 ani) și poate fi păstrat până la 3 luni, la temperaturi cuprinse între 2 și 8 grade Celsius.
În Europa, vaccinul J&J ar putea primi aprobarea condiționată la mijlocul lunii martie.
Eficacitatea generală în prevenirea formelor COVID-19 moderate până la severe este de 66% (la 28 de zile). Eficacitatea în formele severe este de 85% la 28 de zile. Experții avertizează însă că aceste date de eficacitate nu ar trebui comparate în mod direct cu cele ale vaccinurilor bazate pe tehnologia ARNm, deoarece testele au fost făcute într-o perioadă când noile variante virale sunt foarte răspândite, iar obiectivele studiului, descrise diferit.
Documentele EMA și FDA cu recomandări pentru adaptarea vaccinurilor SARS-CoV-2 la noile variante
Pe 25 februarie, Agenția Europeană a Medicamentului (EMA) a emis recomandări cu privire la cerințele pentru producătorii care intenționează să își modifice vaccinurile COVID-19 pentru a aborda noile variante ale SARS-CoV-2. În prezent, trei vaccinuri sunt autorizate pentru utilizare în UE: Comirnaty (Pfizer BioNTech), Moderna și AstraZeneca.
Din datele de până acum, cele trei vaccinuri autorizate oferă protecție împotriva variantelor care sunt răspândite în prezent în Europa, însă există riscul ca odată cu apariția a noi mutații și variante, vaccinurile autorizate să nu mai fie eficiente. Este nevoie ca ele să fie adaptate timpuriu pentru a asigura protecția continuă.
Principiul pe care se bazează ghidul elaborat de CHMP este că o nouă variantă de vaccin se va baza în mare parte pe aceeași tehnologie și platformă ca și vaccinul original – un vaccin deja aprobat în UE pentru prevenirea COVID-19. Diferența ar fi în structura specifică (antigenul) selectată pentru a declanșa răspunsul imun în organism.
Cerințe pentru diferitele tipuri de date:
- Date clinice: nu sunt necesare studii pe scară largă de siguranță și eficacitate. Eficacitatea variantelor de vaccin ar trebui să fie demonstrată în studiile de imunogenitate care sunt concepute pentru a investiga răspunsul imun declanșat de vaccinul îmbunătățit, împotriva variantei virale. EMA recomandă efectuarea a cel puțin unui studiu clinic pe subiecți care nu au fost vaccinați anterior împotriva, sau infectați cu, SARS-CoV-2.
- Studii de laborator (date non-clinice): Nu sunt necesare alte studii de laborator pentru a sprijini dezvoltarea variantelor de vaccin, dar dacă se efectuează, rezultatele vor fi evaluate de CHMP împreună cu datele clinice.
- Calitate și fabricație: se așteaptă ca varianta de vaccin să fie produsă de același producător și în conformitate cu procesele și standardele utilizate pentru vaccinul inițial. În cazul unui vaccin multivalent – unul care conține diferite variante virale – pot fi necesare dovezi suplimentare pentru a asigura calitatea substanțelor active și a produsului final.
FDA a anunțat pe 22 februarie că vaccinurile modificate pentru noile variante nu vor trebui testate pe populații la fel de mari pentru a primi aprobarea. Producătorii ar trebui să prezinte noi date care arată că vaccinul modificat produce un răspuns imun similar celui demonstrat inițial și este sigur, la fel cum se întâmplă în procesul pentru vaccinurile anuale împotriva gripei. FDA se așteaptă ca informațiile de fabricație să rămână în general aceleași pentru un vaccin autorizat și un vaccin modificat de la același producător. Pentru datele clinice, ghidul recomandă ca determinarea eficacității să fie susținută de datele din studiile clinice de imunogenitate. La fel ca și în cazul EMA, producătorii sunt încurajați să studieze vaccinul modificat atât la persoanele nevaccinate, cât și la persoanele vaccinate anterior cu vaccinul autorizat.
De asemenea, pe 24 februarie, Moderna a anunțat că este pregătită să înceapă studiul clinic cu vaccinul împotriva COVID-19 modificat pentru varianta africană (mRNA-1273.351 împotriva variantei B.1.351, identificată pentru prima dată în Republica Africa de Sud). Moderna a livrat primele doze către Institutul Național de Sănătate (NIH) al SUA pentru un studiu clinic de fază 1.
CHMP recomandă cocktail-ul de anticorpi casirivimab + imdevimab pentru aprobare condiționată în UE
Comitetul pentru medicamente de uz uman (CHMP) al EMA a finalizat analiza privind utilizarea anticorpilor monoclonali casirivimab și imdevimab pentru tratarea pacienților cu COVID-19. Agenția a concluzionat că REGN-COV2 poate fi utilizat pentru tratamentul COVID-19 la pacienții care nu necesită oxigen suplimentar și care prezintă un risc ridicat de a progresa la COVID-19 sever. Opinia științifică a CHMP va fi luată în considerare pentru acordarea autorizației condiționate de punere pe piață a combinației. De asemenea, evaluarea pentru fiecare anticorp în parte continuă.
Casirivimab și imdevimab sunt anticorpi monoclonali direcționați împotriva proteinei S (spike) a virusului SARS-CoV-2, concepute pentru a bloca atașarea și intrarea virusului în celulele umane.
Studii de caz CDC: Risc de transmitere a noului coronavirus în timpul sesiunilor de antrenament la sala de sport, în ciuda respectării distanțării fizice, dacă masca nu este purtată
Sălile de sport pot deveni adevărate focare COVID-19 dacă persoanele nu poartă măști de protecție în timpul antrenamentelor, chiar dacă respectă distanțarea fizică recomandată. CDC a publicat două rapoarte privind această chestiune (din Hawaii și Chicago). Recomandările CDC sunt de a evita pe cât posibil antrenamentele înăuntru, iar dacă nu se poate, purtarea măștii de protecție, distanțarea și aerisirea corespunzătoare a spațiului, trebuie să fie îndeplinite în același timp.
În cazul Hawaii, 21 de persoane s-au infectat (iulie 2020) după ce au participat timp de 3 zile la o sesiune de pedalat în sala de sport, predată de un instructor care a fost testat pozitiv pentru COVID-19 câteva zile mai târziu (cursurile au fost predate înainte de instalarea simptomelor). Bicicletele au fost distanțate la 2m, însă nimeni nu a purtat mască. Mai mult, unul dintre participanți a fost un alt instructor, care a predat kickbox după, infectând la rândul său alte persoane. Conform autorităților din Hawaii, transmiterea comunitară (medie la 7 zile) în acea perioadă era de 2-3 cazuri la 100.000 de locuitori/ zi.
În Chicago, 55 din 81 de persoane care au participat la cursuri de fitness de intensitate ridicată în august 2020 au contractat COVID-19. Cursurile erau limitate la 10-15 persoane, iar oamenii erau poziționați la o distanță de aproximativ 2m. Sala de sport a impus purtarea măștii la intrarea în incintă, a efectuat verificări ale temperaturii și ale simptomelor, dar oamenilor li s-a permis să-și scoată măștile în timpul exercițiului.
Global Health: prima platformă open-access pentru înregistrarea și vizualizarea în timp real a informațiilor anonimizate despre cazurile COVID-19 confirmate la nivel mondial
Pe 24 februarie a fost lansată Global.health – o platformă de date stocate în cloud pentru înregistrarea cazurilor individuale de COVID-19, anonimizate. Așadar, o serie de metadate despre cazurile COVID-19, care ar putea fi agregate datelor genomice, obținute în urma secvențierilor, dar nu numai. Înregistrările conțin date despre istoricul de călătorie al persoanei, data diagnosticării, informații despre sănătate sau informații clinice, date demografice, de sex, etnice etc. Acestea pot fi utilizate pentru studierea diferitelor trenduri în ceea ce privește infecțiile COVID-19 și pentru a influența decizii de sănătate publică.
Proiectul este susținut de Google.org, cu sprijin suplimentar de la Fundația Rockefeller și este condus de academicieni de la Universitatea Oxford, Harvard, Northeastern, Boston Children’s Hospital, Georgetown, Universitatea din Washington, și Johns Hopkins Center for Health Security.
Ideea a pornit cu un grup de voluntari care înregistrau aceste date în Google spreadsheet (aproximativ 80.000 de înregistrări pot fi făcute) și le puneau la dispoziția publicului. Samuel Scarpino, directorul Laboratorului de epidemii emergente al Universității Northeastern nu era sigur cum va evolua situația cu noul coronavirus în februarie 2020, așa că a început să colecteze date cu ajutorul voluntarilor. Problema a apărut când au atins maximul de înregistrări permise în spreadsheet. Le-a venit ideea de a scrie către Google.org pentru asistență. Astfel a început crearea platformei, lansată 1 an mai târziu.
Iată care este situația vaccinurilor aprobate sau în curs de aprobare în UE, până la această dată:
Citiți știrile esențiale COVID-19 din săptămânile anterioare.

