Terapiile celulare CAR-T pentru mielomul multiplu: cum funcționează agenții anti-BCMA și care sunt cele mai importante date din studiile clinice
Dezvoltarea tehnologiilor care permit reprogramare a celulelor efectoare ale sistemului imun a deschis o nouă etapă în tratamentul cancerului, care a culminat cu succesul terapiilor celulare CAR-T, considerate cel mai înalt grad posibil de personalizare a tratamentului oncologic. Acestea implică modificarea genetică a limfocitelor T ale pacientului și reintroducerea lor în organism pentru a recunoaște și distruge cu mare specificitate celulele canceroase. Terapiile CAR-T au demonstrat rezultate fără precedent la pacienții cu neoplasme hematologice cu celule B, la care opțiunile de tratament erau epuizate. În 2017, FDA aproba primele două terapii CAR-T anti CD-19 și un an mai târziu acestea primeau aprobare și în UE. Societatea Americană de Oncologie Clinică a declarat terapiile CAR-T inovația anului 2018.
Mielomul multiplu (MM), unul dintre cele mai frecvente cancere hematologice la adulți, reprezintă o nouă indicație pentru care sunt evaluate terapiile CAR-T. În ciuda crizei de sănătate publică generată COVID-19, în anul 2021, prima terapie CAR-T pentru mielomul multiplu a primit aprobare din partea FDA și EMA și se așteaptă în 2022 decizia autorităților internaționale și pentru a doua terapie. Pe lângă acestea, alte terapii CAR-T anti-BCMA se află în studii preclinice și clinice, iar noi clase de imunoterapii (ex. anticorpii bispecifici, conjugatele anticorp-medicament) sunt explorate pentru MM. Dezvoltarea imunoterapiei marchează o nouă etapă în tratamentul MM și se estimează că în următorii 5 ani managementul bolii se va schimba semnificativ, la fel cum s-a întămplat în urmă cu 30 de ani când s-a introdus transplanul autolog de celule stem sau în urmă cu 20 de ani, odată cu introducerea inhibitorilor de proteazom și a medicamentelor imunomodulatoare.
Evoluția opțiunilor terapeutice pentru MM
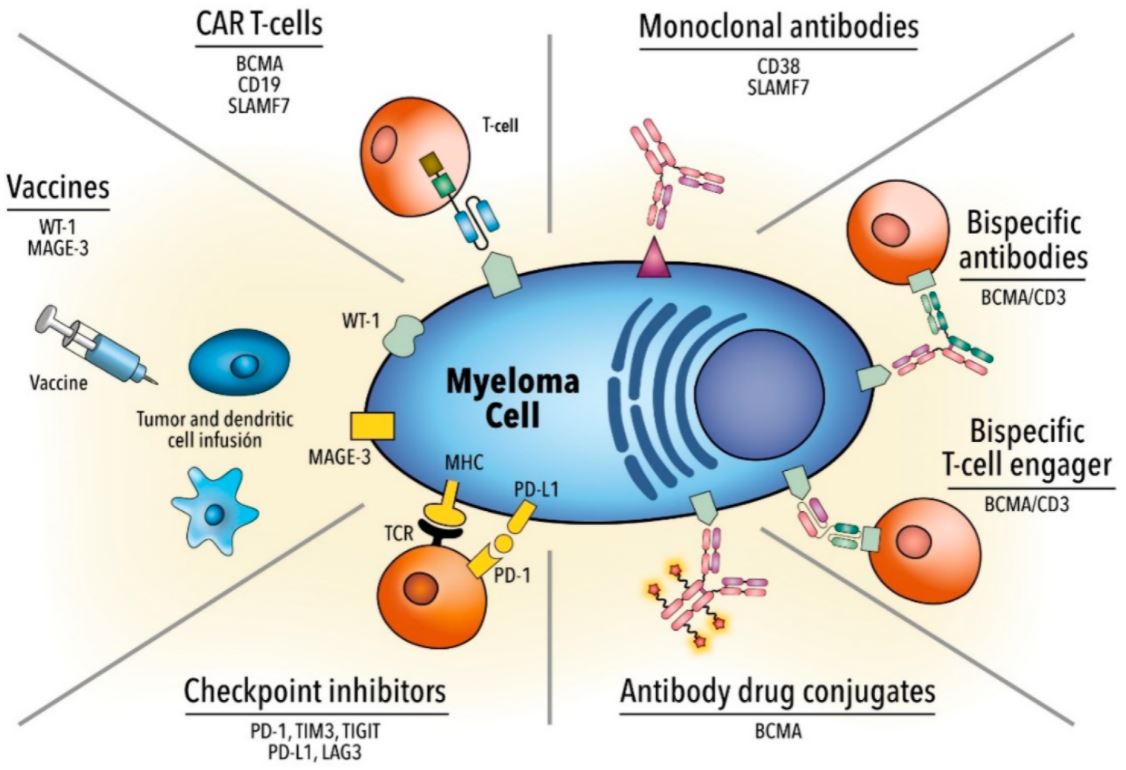
Dacă la mijlocul anilor ’90, supraviețuirea la 5 ani era de aproximativ 30%, până în 2016 aceasta s-a dublat. În ultimul deceniu, cele mai mari progrese au fost reprezentate de terapiile obținute prin biotehnologie. Primele tipuri de imunoterapii care au demonstrat rezultatele superioare față de standardul terapeutic în MM au fost anticorpii monoclonali: daratumumab și isatuximab care țintesc markerul CD38 de pe suprafața plasmocitelor transformate malign și elotuzumab, care țintește SLAMF7. Acești noi agenți au demonstrat creșterea supraviețuirii la pacienții nou-diagnosticați și la cei cu forme recidivante.
O dimensiune mai nouă a terapiilor țintite e reprezentată de conjugatele anticorp-medicament. Belantamab mafodotin este o astfel de terapie, care țintește BCMA, o glicoproteină transmembranară ce face parte din superfamilia receptorilor TNF, care au o expresie crescută pe plasmocitele maligne ce caracterizează MM.
O altă strategie de stimulare a limfocitelor T care câștigă teren este cea bazată pe anticorpi bispecifici. Aceștia sunt proteine artificiale, formate din fragmente de imunoglobuline, care acționează ca o punte, aducând celula imună și celula tumorală în contact.
Pacienții care sunt refractari la inhibitorii de proteazom, la imunomodulatoare, la anticorpii anti-CD38 au un prognostic nefavorabil. După fiecare recădere, ratele de răspuns sunt din ce în ce mai scăzute, durata răspunsului se diminuează. Mai ales pentru cazurile refractare/cu recidive , care au urmat multiple linii terapeutice, sunt necesare noi tipuri de terapii care se adresează unor mecanisme diferite.
Rezultatele demonstrate de terapiile CAR-T în anumite tipuri de leucemii și limfoame au determinat extinderea acestui tip de terapie celulară și pentru alte cancere hematologice și solide. Studiile clinice care au evaluat terapiile CAR-T anti-BCMA au demonstrat rate de răspuns fără precedent la pacienți tratați cu multiple linii terapeutice pentru mielomul multiplu.
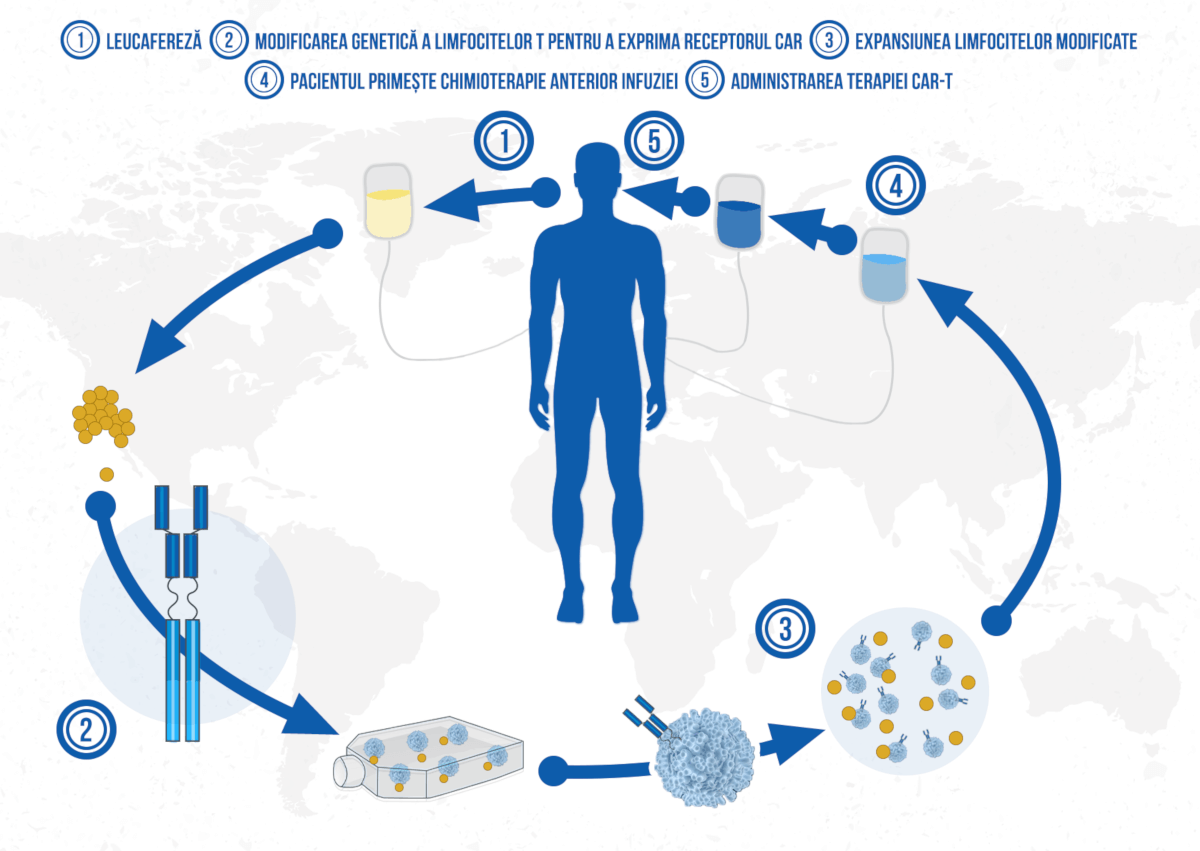
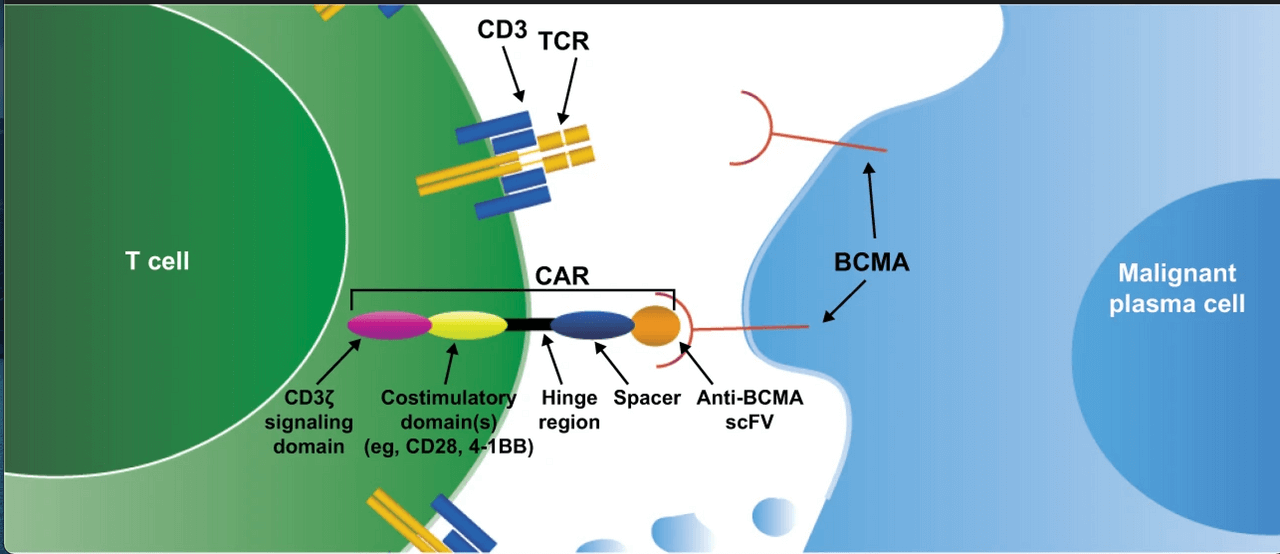
CAR-T este o terapie înalt personalizată (considerată simultan terapie celulară, terapie genică și imunoterapie) prin care limfocitele T ale pacientului modificate genetic pentru a exprima un receptor care are o mare specificitate pentru celulele canceroase. Cel mai important factor care determină succesul terapiei CAR-T este alegerea antigenului țintă. Acesta trebuie să fie exprimat într-o cantitate suficientă și distribuit uniform pe celulele tumorale și să lipsească pe suprafața celulelor sănătoase ale pacientului.
O nouă țintă pentru terapia celulară CAR-T: markerul BCMA
Principiul de acțiune al CAR-T îi permite să fie adaptată pentru diferite tipuri tumorale, țintind diferiți markeri de la suprafața celulelor maligne. CD19, antigenul exprimat mai ales pe suprafața limfocitelor B, a reprezentat o țintă importantă pentru primele terapii CAR-T care au fost aprobate internațional deja. Pentru extinderea utilizării CAR-T și pentru alte cancere hematologice, dar și în neoplasmele solide, cercetările se orientează spre descoperirea de noi markeri moleculari.
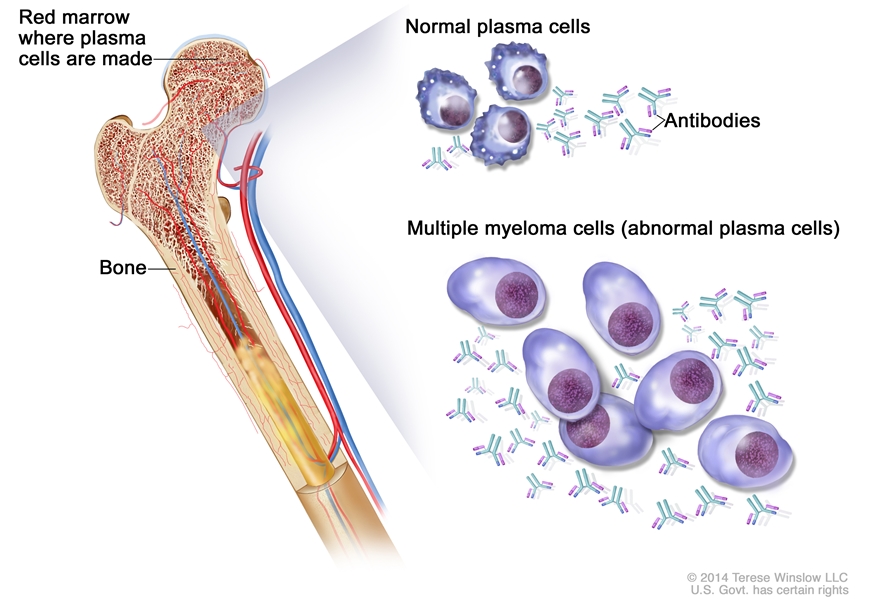
Celulele afectate în MM sunt plasmocitele de la nivelul măduvei osoase hematogene, care au rol în producerea de anticorpi. Aceste celule se transformă malign, proliferează și produc proteine anormale – utilizate drept markeri pentru diagnosticul și urmărirea pacienților: proteina M (paraproteina) și lanțurile ușoare (componente normale ale imunoglobulinelor, însă produse în cantități anormale de către celulele tumorale). Celulele canceroase și proteinele patologice produse înlocuiesc celulele imune sănătoase de la nivel medular, conducând la afectarea sistemului imunitar, precum și la afectarea osoasă și renală.
Cea mai studiată țintă în cazul terapiilor CAR-T pentru mielomul multiplu este BCMA (antigenul specific limfocitelor B mature), un membru al familiei TNF, exprimat mai ales de către celulele plasmatice normale și maligne, precum și de unele celule B mature. BCMA nu este exprimat de către celulele stem hematopoietice sau de către celule nonhematologice. Expresia BCMA în plasmocitele transformate malign este crescută comparativ cu celulele normale, iar această expresie de asociază cu proliferarea și supraviețuirea celulelor tumorale și contribuie la micromediul imunosupresor de la nivelul măduvei osoase.
Numărul receptorilor BCMA de pe suprafața celulelor crește pe măsură ce boala progresează. Din cauza localizării specifice la nivelul plasmocitelor, fără a fi exprimat pe alte tipuri de celule BCMA este o țintă ideală pentru terapiile celulare CAR-T.
Momentul actual
În prezent, se estimează peste 50 de studii clinice în derulare cu terapii CAR-T anti-BCMA. Trialurile care evaluează terapiile CAR-T la pacienții cu mielom multiplu, care nu răspund la 3 linii standard de tratament, raportează rate generale de răspuns care variază între 81% și 97% și rate de remisiune completă de 45-67%. O meta-analiză publicată în 2020, care a inclus 23 de terapii CAR-T anti-BCMA (640 de pacienți tratați în total), raportează o rată generală de răspuns de 80,5%, 44% răspunsuri complete și o rată de supraviețuire fără progresia bolii de 12,2 luni.
Idecabtagene vicleucel, prima terapie CAR-T autorizată de FDA pentru MM
În martie 2021, idecabtagene vicleucel (Abecma) a devenit prima terapie CAR-T aprobată pentru tratamentul pacienților adulți cu mielom multiplu recidivant sau refractar la patru sau mai multe linii terapeutice.
- Siguranța și eficacitatea terapiei au fost evaluate în studiul KarMMa de fază II, în care s-a observat o rată globală de răspuns de 73%, iar 33% dintre pacienți au înregistrat un răspuns complet;
- Timpul mediu până la răspuns a fost de 30 de zile, iar răspunsurile au fost durabile în timp, cu o durată mediană a răspunsului de 10,6 luni.
În august 2021, Comisia Europeană a aprobat condiționat această terapie, după ce aceasta a intrat în mecanismul PRIME al Agenției Europene a Medicamentului, prin care a fost accelerată evaluarea.
Ciltacabtagene autoleucel (cilta-cel), în curs de evaluare în UE și SUA
Cele mai recente rezultate din studiul studiul de fază Ib/II CARTITUDE-1 au fost prezentate anul acesta în cadrul Întâlnirii Anuale a Societății Americane de Oncologie Clinică 2021 (ASCO) și la Întâlnirea Anuală SOHO 2021 (Society of Hematologic Oncology).
Studiul a inclus un grup de 97 de pacienți cu vârsta medie de 61 de ani, care au primit cel puțin 3 linii terapeutice anterior (între 3 și 18). 66% dintre pacienți au primit 5 sau mai multe linii terapeutice.
- După o perioadă mediană de follow-up de 18 luni, terapia CAR-T a condus la o rată generală de răspuns de aproape 98%, o rată de răspuns complet de 80,4%, rată generală de răspuns de 81%;
- Durata mediană a răspunsului a fost de 21,8 luni;
- Răspunsurile au fost susținute pentru toate grupurile studiate (inclusiv cazuri tratate anterior, cazuri refractare, plasmocitoame extrameduale și la risc citogenetic).
91,8% dintre pacienți erau negativi la evaluarea bolii minime reziduale. Pentru întregul grup de studiu, rata de negativare MRD a fost de 57,7%. Acestea sunt cele mai bune rezultate obținute pe parcursul studiului în ceea ce privește MRD, date care sugerează un răspuns care se îmbunătățește în timp.
20,6% din pacienți au prezentat diferite forme de neurotoxicitate, dintre care 10 pacienți au prezentat evenimente de grad 3 sau mai mare. 94,8 % din pacienți au dezvoltat sindromul de eliberare de citokine (CRS), care a avut o perioadă medie până la debut de 7 zile și o durată medie de 4 zile. Cele mai multe cazuri (94,4%) au fost de grad 1 sau 2 și s-au rezolvat în primele două săptămâni. Pe măsură ce a crescut perioada de follow-up nu s-au observat noi tipuri de reacții secundare.
Cilta-cel este evaluat, în prezent, în studiile în derulare de fază 2 – CARTITUDE-2 și studiul CARTITUDE-4 (studiu de fază III).
Cilta-cel a primit deja statutul de terapie inovatoare din partea FDA și a intrat în programul de evaluare prioritară (priority review). Decizia finală se așteaptă la începutul anului 2022, iar dacă este aprobată, terapia ar deveni a doua disponibilă în SUA. La nivel UE, cilta-cel a intrat în schema PRIME în 2019, iar anul acesta, Agenția Europeană a Medicamentului a început evaluarea accelerată a terapiei. Decizia finală este estimată pentru anul 2022.
Orvacabtagene autoleucel (orva-cel)
Un alt agent anti-BCMA care a demonstrat un profil bun de siguranță la pacienții cu MM recidivat/refractar, în studiul de fază I EVOLVE, este orva-cel, o terapie CAR-T de generația a-II-a. Această terapie folosește un domeniul de legare BCMA complet umanizat și prezintă o afinitate foarte redusă pentru proteina BCMA solubilă. Datele prezentate la ASCO 2020 arată că rata generală de răspuns a fost de 92%, iar 84% dintre pacienți erau și MRD-negativi.
Domeniul terapiilor CAR-T pentru MM este în plină expansiune, cu un număr impresionant de studii clinice, reprezentând toate fazele de dezvoltare și care evaluează diferite structuri CAR și diferite ținte. De asemenea, terapii noi care țintesc alte molecule implicate în MM (CD138, CD28 + CD19, SLAMF7 ) au fost deja validate sau sunt în dezvoltare, astfel încât opțiunile de tratament pentru formele refractare/recidivate de boală vor crește în anii următori. Cu fiecare terapie aprobată complexitatea diagnosticului va fi, de asemenea, mai mare. Pentru asigurarea eficacității terapiilor CAR-T vor fi necesare strategii pentru identificarea precoce a pacienților eligibili și extinderea utilizării biomarkerilor.
O altă strategie explorată în prezent în studii clinice implică administrarea terapiilor CAR-T anti-BCMA în faze mai puțin avansate de boală. De asemenea, alte tipuri de terapii CAR-T sunt studiate, de exemplu terapiile CAR-NK, ce folosesc alte celule ale sistemului imun.

Alegerea terapiei potrivite pentru pacientul potrivit
Deși s-au înregistrat progrese majore în ceea ce privește supraviețuirea în MM, există diferențe importante între prognosticul pacienților. În anumite cazuri, rata de supraviețuire fără progresia bolii poate să fie de peste 15 ani, în timp ce alți pacienți nu supraviețuiesc mai mult de 2 ani (aproximativ 15% din cazuri). Explicația acestor variații este legată de hetereogenitatea moleculară a bolii, ceea ce sugerează că un singur tip de terapie țintită sau imunoterapie nu poate funcționa pentru toți pacienții.
Pacienții cu MM la risc înalt, care reprezintă un sfert din cazurile nou diagnosticate înregistrează precoce recăderi, devin refractari de la primele linii de tratament. De asemenea, majoritatea celor care sunt inițial la risc scăzut dezvoltă mecanisme de rezistență și devin ulterior refractari la tratament. De aceea, este esențial să se identifice la timp atât cazurile active la risc înalt cât și cei cu risc de progresie nefavorabilă. Alegerea terapiei potrivite depinde de stratificarea corectă a pacienților, atât în ceea ce privește fenotipul cât și analiza profilului molecular . Surprinderea heterogenității moleculare a bolii este facilitată astăzi de tehnologiile de secvențiere genomică, de analiza expresiei genice, a profilului metabolic, proteomului, care conduc la descoperirea de noi biomarkeri.
Un studiu recent introduce o nouă metodă de clasificare a mielomului multiplu (MM), pe baza unul algoritm care integrează seturi de date complexe provenite din analiza genomică și transcriptomică. Pe baza analizei multiomice au fost identificate 12 subgrupuri ale bolii, caracterizate de profiluri de risc diferite și pentru care pot fi identificate terapii specifice. Fiecare subgrup ar putea răspunde diferit la terapii țintite și la imunoterapii. În cadrul studiului au fost definite inclusiv categorii de pacienți care prezintă o expresie scăzută a markerului BCMA și care nu ar avea un răspuns bun la terapia CAR-T anti-BCMA.
Citește și:
- FDA aprobă prima terapie celulară anti-BCMA pentru pacienții cu mielom multiplu recidivat și refractar la cel puțin patru terapii anterioare
- Prima terapie celulară CAR-T pentru pacienții adulți cu mielom multiplu recidivat și refractar, aproape de aprobare condiționată în UE

