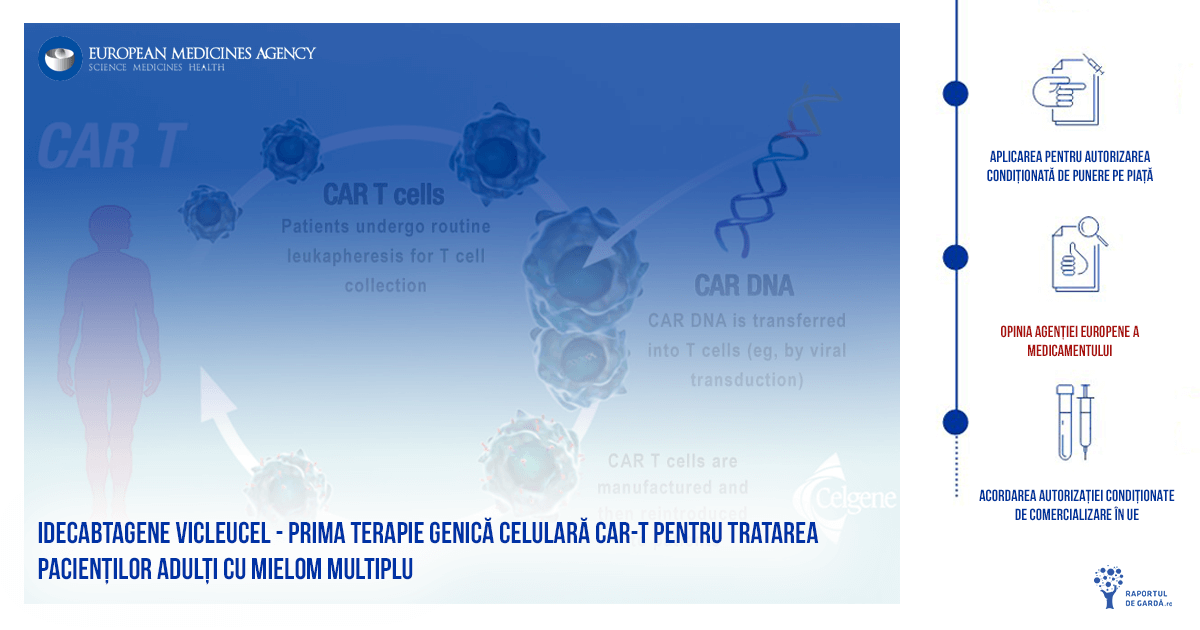
Prima terapie celulară CAR-T pentru pacienții adulți cu mielom multiplu recidivat și refractar, aprobată condiționat în UE
Update august 2021: Comisia Europeană (CE) a acordat autorizația condiționată de introducere pe piață.
Iunie 2021: EMA (Agenția Europeană a Medicamentului) a recomandat acordarea autorizației condiționate de introducere pe piață (CMA) în Uniunea Europeană (UE) pentru Abecma (idecabtagene vicleucel) pentru tratamentul pacienților adulți cu mielom multiplu recidivant și refractar care au primit cel puțin trei terapii anterioare, inclusiv un agent imunomodulator, un inhibitor de proteazom și un anticorp anti-CD38 și a căror boală a continuat să avanseze de la primirea ultimului tratament. Aceasta este prima terapie celulară genică CAR-T pentru tratarea pacienților adulți cu mielom multiplu.
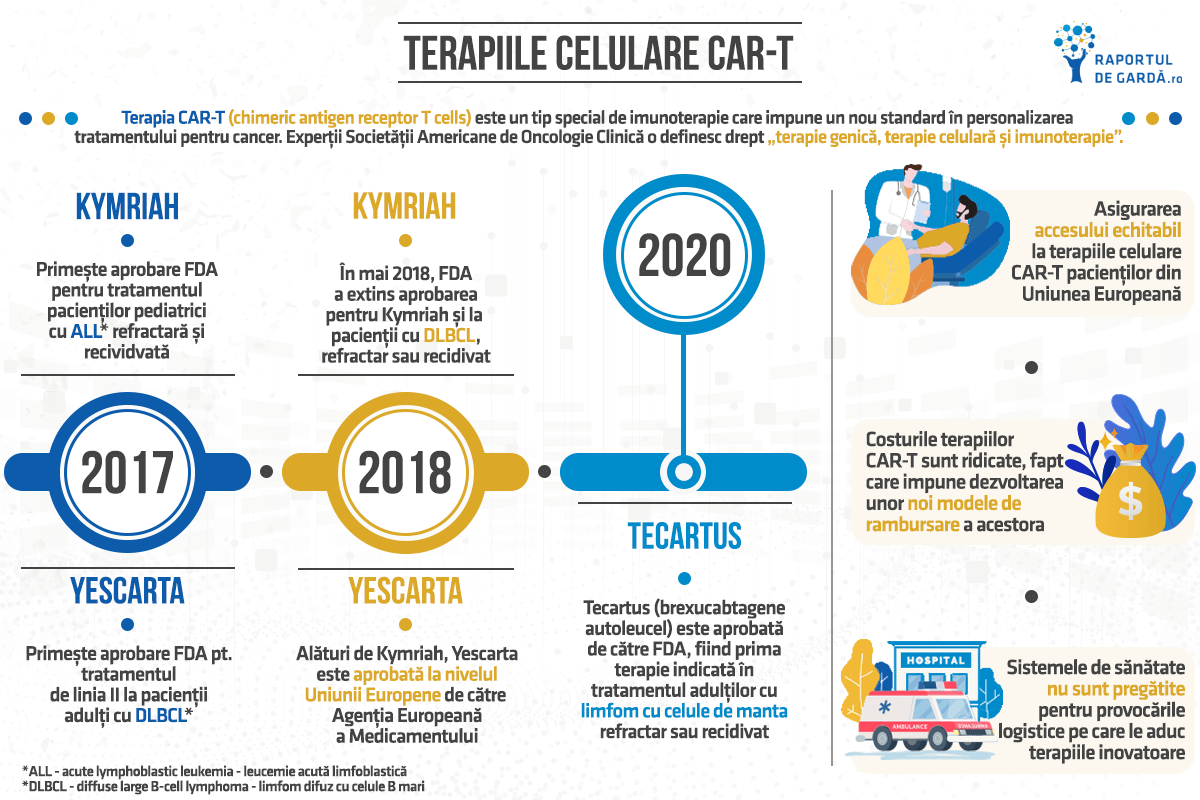
Idecabtagene vicleucel este o terapie bazată pe celule CAR (chimeric antigen receptor)-T. La fel ca și primele terapii genice celulare CAR-T aprobate – Kymriah (tisagenlecleucel) și Yescarta (axicabtagene ciloleucel) – fiecare doză de Abecma este creată prin colectarea propriilor celule T ale pacientului și modificarea genetică a acestora, astfel încât să includă o nouă genă care ajută organismul să țintească și să distrugă celulele transformate malign. Aceste celule imune modificate sunt apoi introduse prin perfuzie înapoi în organismul pacientului.

Dezvoltarea Abecma a fost sprijinită de către EMA prin sistemul PRIority MEdicines (PRIME), care implică sprijin științific și de reglementare timpuriu și îmbunătățit pentru medicamentele care au un potențial special de a răspunde nevoilor medicale nesatisfăcute ale pacienților.
Ce urmează din punct de vedere al aprobării
De obicei, Comitetul pentru produse medicale de uz uman (CHMP) este cel care se ocupă de evaluarea noilor medicamente care urmează a fi aprobate, însă având în vedere că Abecma este o terapie de nouă generație, CAT – Comitetul pentru terapii avansate din cadrul EMA a fost responsabil pentru evaluare, luând decizia împreună cu CHMP.
Opinia comitetelor EMA este un pas intermediar – evaluarea urmează a fi înaintată către Comisia Europeană, care va emite, în final, autorizația condiționată. După acordarea CMA, urmează stabilirea prețului și rambursarea la nivelul fiecărui stat membru. În România, se aplică politica celui mai mic preț din UE la medicamente, iar această politică duce la timpi foarte mari de așteptare până când pacienții români au acces la medicamente inovatoare. Conform Patients WAIT survey, pot trece până la 883 de zile (aproximativ 2 ani și jumătate) pentru ca pacienții români să aibă acces la un medicament de ultimă generație, în regim compensat. În plus, pentru că este vorba despre o terapie care se administrează în regim special, este nevoie de un centru acreditat. În România, Institutul Clinic Fundeni este centrul care se află în curs de acreditare și în care se vor putea administra terapiile CAR-T care sunt disponibile la noi în țară.
Date din studiul care a condus la aprobarea condiționată
Datele pe care se bazează recomandarea pentru CMA provin dintr-un studiu clinic de fază 2, multicentric, deschis, cu un singur braț. Studiul a investigat eficacitatea și siguranța Abecma la 140 de pacienți adulți cu mielom multiplu recidivant sau refractar care au primit cel puțin trei terapii anterioare, inclusiv un agent imunomodulator, un inhibitor de proteazom și un anticorp anti-CD38 și care nu au răspuns la ultimul regim de tratament.
- Aproximativ 67% dintre pacienții înscriși în studiu au răspuns la tratament și au rămas în remisiune timp de aproximativ 11 luni, în medie;
- 30% dintre pacienții incluși în studiu au prezentat un răspuns complet la tratament.
La fel ca și la celelalte terapii CAR-T, principalele probleme de siguranță legate de administrare sunt sindromul de eliberare de citokine (CRS), toxicitatea neurologică, citopeniile și infecțiile, care pot pune viața în pericol. De aceea, monitorizarea și intervenția precoce sunt esențiale în administrarea de astfel de terapii. Ele se pot administra doar în centre autorizate.
Statutul PRIME și de medicament orfan
Abecma a fost acceptată în schema PRIME la 10 noiembrie 2017, iar statutul de medicament orfan i-a fost desemnat în aprilie 2017. În urma acestui aviz pozitiv al CHMP, Comitetul pentru produse medicamentoase orfane (COMP) va evalua dacă ar trebui menținută denumirea de medicament orfan.
Un produs medical orfan reprezintă un produs pentru diagnosticul, prevenirea sau tratamentul unei afecțiuni care pune viața în pericol sau care afectează cronic pacientul, care este rară (afectează nu mai mult de cinci din 10.000 de persoane din Uniunea Europeană) sau în care este puțin probabil ca medicamentul să genereze profit suficient pentru a justifica cercetarea și dezvoltarea sa.
Informații despre mielomul multiplu
Mielomul multiplu este un cancer hematologic rar care afectează plasmocitele. Acestea se găsesc în măduva osoasă și sunt o parte importantă a sistemului imunitar. Celulele plasmatice produc anticorpii care permit organismului să recunoască și să atace agenți patogeni, precum virusurile sau bacteriile. În mielomul multiplu, proliferarea celulelor plasmatice este scăpată de sub control, ducând la înmulțirea anormală a celulelor plasmatice. Atunci când celulele plasmatice devin canceroase, ele nu mai protejează organismul de infecții și produc proteine anormale care pot afecta rinichii, sistemul osos sau sistemul circulator.
În ciuda dezvoltării și aprobării unei game de noi medicamente pentru tratamentul mielomului multiplu în ultimii ani, există opțiuni terapeutice limitate pentru pacienții care au primit deja trei clase majore de medicamente (agenți imunomodulatori, inhibitori de proteazomi și anticorpi monoclonali) și nu mai răspund la aceste medicamente. Prin urmare, sunt necesare medicamente noi pentru pacienții a căror boală revine după tratament.
Decizia de înaintare a propunerii CMA către CE a fost luată în cadrul întâlnirii CHMP din 21-24 iunie 2021. Alături de Abecma, ale 7 terapii noi au primit aviz pozitiv, dintre care 2 sunt medicamente generice:
- bimekizumab (pentru tratamentul psoriazisului în plăci, moderat până la sever);
- ranibizumab (tratamentul degenerescenței maculare neovasculare și altor afecțiuni oculare);
- roxadustat (tratamentul simptomelor anemiei la pacienții cu afecțiuni renale cronice);
- tafasitamab (tratamentul pacienților adulți cu limfom difuz recidivant sau refractar cu celule B mari (DLBCL) care nu sunt eligibili pentru transplantul de celule stem autolog);
- vosoritide (tratamentul acondroplaziei la pacienții cu vârsta de peste 2 ani);
- abiraterone acetate (tratamentul cancerului de prostată metastatic);
- fingolimod (tratamentul sclerozei multiple recidivante-remitente cu activitate crescută a bolii).
Citește și:
- CAR-T, tratamentul oncologic creat pentru fiecare pacient în parte: care sunt provocările pentru extinderea utilizării terapiilor celulare în practică?
- Terapiile CAR-T, o nouă dimensiune a personalizării tratamentului oncologic: cum diferă față de terapiile clasice și care sunt progresele în managementul cancerelor hematologice
- Noile generații de terapii CAR-T: cele mai importante studii prezentate la ASH 2019