#BiotechWeek2020. Ce sunt și cum funcționează terapiile celulare CAR-T?
Terapia celulară presupune transferul de celule pentru a înlocui sau a repara țesuturi afectate. Aplicațiile terapiilor celulare s-au extins în prezent în două domenii: medicina regenerativă și oncologia. În oncologie, celulele imune, cum sunt celulele dendritice sau limfocitele T, sunt explorate în diferite strategii terapeutice. Succesul terapiilor celulare CAR-T, care sunt considerate cel mai înalt grad posibil de personalizare a tratamentului, a deschis o nouă etapă în oncologie.
Terapia CAR-T (chimeric antigen receptor T cells) este un tip special de imunoterapie care impune un nou standard în personalizarea tratamentului pentru cancer. Experții ASCO (Societatea Americană de Oncologie Clinică) o definesc drept „terapie genică, terapie celulară și imunoterapie”.
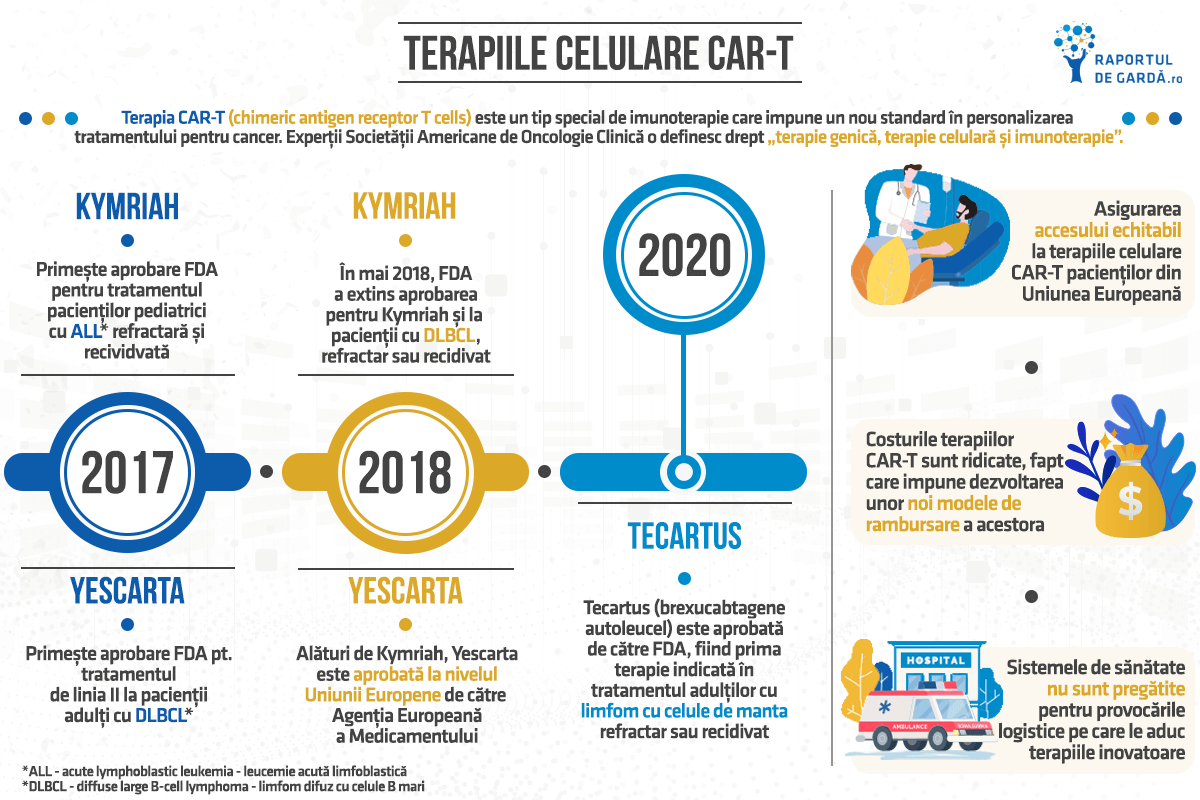
Simplificat, terapiile CAR-T reprezintă o metodă nouă care folosește activarea propriului sistem imun al organismului pentru a lupta împotriva celulelor tumorale. Primele două terapii celulare CAR-T care au primit aprobare din partea FDA (Food and Drug Admnistration) în 2017 au fost Kymriah (tisagenlecleucel) și Yescarta (axicabtagen ciloleucel), ambele fiind terapii CAR-T de generația a doua, împotriva CD-19.
Ascultați al patrulea episod – terapiile celulare CAR-T, al podcastului RaportuldeGardă.ro, o ediție specială, realizată în colaborare cu Centrul pentru Inovație în Medicină:
Cum funcționează terapiile celulare CAR-T?
Așa cum sugerează și numele, terapia CAR-T are la bază celulele T ale organismului uman, care sunt „caii de bătaie” ai sistemului imun datorită rolului critic pe care îl joacă în orchestrarea răspunsului imun. Acestea pot face diferența între celulele sănătoase și cele anormale (infectate sau transformate malign).
Terapia CAR-T presupune recoltarea de sânge de la pacient și separarea celulelor T. Mai exact, prelevarea leucocitelor de la pacient printr-o tehnică denumită leucafereză. Celulele sunt apoi transportate într-o fabrică special echipată pentru procedurile care urmează.
Folosind un virus inactivat, celulele T sunt reprogramate cu ajutorul ingineriei genetice, astfel încât să exprime receptori pe suprafața lor – receptori ai antigenului chimeric (CAR). Acești receptori sunt molecule sintetice, nu există natural, însă permit celulelor T să identifice și să se atașeze de o proteină specifică, un antigen, prezent la suprafața celulelor tumorale. Dezvoltarea terapiilor CAR-T țintește antigenul găsit pe suprafața celulelor B – CD19.
Odată ce celulele T ale pacientului au fost modificate pentru antigenul CAR, sunt multiplicate în bioreactoare în număr de sute de milioane. La final, volumul lor poate atinge câțiva litri – cantitate mult prea mare pentru a fi infuzată. De aceea, este necesară concentrarea lor.
Apoi, ele sunt retrimise către centrul medical unde se află pacientul, pentru etapa următoare a terapiei. Însă cu câteva zile înainte de administrarea propriu-zisă a terapiei, este necesară o etapă de limfodepleție, cu rolul de a scădea numărul de celule imune din organismul pacientului și a facilita expansiunea terapiei CAR-T in vivo, pregătindu-l pentru a primi infuzia limfocitelor T. Aceasta se realizează prin chimioterapie.
Pasul final este reintroducerea celulelor în organismul pacientului. Dacă totul merge conform planului, celulele introduse încep să se multiplice în interiorul organismului, recunoscând și distrugând celulele canceroase.

Terapii CAR-T aprobate
În mai 2018, FDA a extins aprobarea pentru Kymriah și la pacienții cu DLBCL refractar sau recidivat (limfom difuz cu celule B mari). Astfel, Kymriah a devenit prima terapie CAR-T cu două indicații în neoplasmele hematologice. Societatea Americana de Oncologie Clinică (ASCO) a desemnat terapiile celulare CAR-T drept Inovația Anului 2018. La un an de la aprobarea în SUA, terapiile CAR-T, Kymriah și Yescarta, au fost aprobate și în Uniunea Europeană, fiecare cu câte două indicații. Kymriah este indicată la copii și tineri sub 25 de ani cu o formă refractară sau recidivată de ALL și la adulții cu DLBCL. Yescarta a primit aprobare pentru DLBCL și pentru limfom mediastinal primar cu celule B mari.
La mijlocul anului 2020, FDA a aprobat prin procedură accelerată Tecartus (brexucabtagene autoleucel), prima terapie CAR-T pentru tratamentul adulților cu limfom cu celule de manta, refractar sau recidivat.
Costurile terapiilor CAR-T și provocările legate de acces
În cadrul Congresului Societății Americane de Hematologie 2019 (ASH), au fost prezentate mai multe date despre provocările CAR-T în practica medicală curentă. Datele post-marketing au demonstrat o rată generală de răspuns și rată de răspuns complet mai mare decât în studiile inițiale care au condus către aprobare. Profilul de siguranță a fost similar. Mai mult, comparând utilizarea asistenței medicale în cele 6 luni dinainte de administrare și de după administrarea CAR-T, specialiștii au constatat că, în medie, costul general al asistenței medicale necesare a scăzut cu 40% după administrarea terapiei celulare, excluzând costul tratamentului în sine.
Sistemul național de asigurări de sănătate din SUA, Centers for Medicare and Medicaid Services (CMS), a introdus în 2001 un sistem de plată pentru tehnologiile inovatoare care impun cheltuieli foarte mari – New-Technology Add-On Payments.
Conform noilor reglementări, bugetul suplimentar pentru terapiile CAR-T a fost crescut de la 50% la 60% pentru 2020. La rândul lor, companiile farmaceutice au răspuns îngrijorărilor legate de costuri prin înțelegeri bazate pe rezultate.
Pacienții din Marea Britanie au avut acces rapid la aceste terapii printr-o decizie istorică emisă în octombrie 2018 de Serviciului Național de Sănătate (NHS – National Health Services). Prin intermediul programului Cancer Drugs Fund s-a decis compensarea terapiei CAR-T pentru pacienții cu vârste de până la 25 de ani cu leucemie acută limfoblastică.
Comparativ cu atenția acordată costurilor terapiilor CAR-T și modalităților de finanțare, mult mai puțină importanță a fost acordată poverii economice pe care trebuie să o suporte pacienții și familiile acestora. Datele arată că decizia de a începe tratamentul este uneori întârziată din cauza costurilor parțiale pe care trebuie să le acopere pacienții.
De asemenea, este important de menționat că administrarea terapiilor CAR-T se lovește încă de bariere, iar accesul pacienților nu este unitar. Sistemele de sănătate nu sunt pregătite pentru provocările logistice pe care le aduc terapiile inovative. Terapia CAR-T este un exemplu foarte bun pentru importanța procesului de pregătire și de angajare cât mai rapidă a liderilor de opinie, așa cum s-a observat în Marea Britanie. Spania și Marea Britanie au apelat la acorduri publice-private (managed entry agreements – MAE) bazate pe rezultate și este foarte probabil că același lucru se va întâmpla și în alte state. Aceste înțelegeri permit plătitorilor să echilibreze mai bine bugetele și prețul plătit pentru inovație, iar producătorilor le oferă încredere că produsele lor vor fi bine răsplătite atunci când terapia funcționează.
Nu toți pacienții răspund la terapiile CAR-T, iar acest lucru se întâmplă din varii motive, precum factorii tumorali intrinseci (încărcătură tumorală mare, modificări ale expresiei epitopilor de pe suprafața celulelor tumorale; încărcătură mare a semnalelor inhibitorii din preajma celulelor CAR-T) sau factori ce țin de gazdă (numărul de tratamente precedente; protocoale diferite de chimioterapie folosite pentru depleția celulelor CAR-T; cinetica celulelor CAR-T).
Ce urmează?
Un studiu preclinic prezentat recent propune modificarea unei celule care, spre deosebire de limfocitul T, face parte din apărarea înnăscută a organismului: NK (natural killer cells). Aceasta poate fi modificată pentru a exprima mai mulți markeri tumorali (CD19, CD16, IL15). Celulele CAR-NK ar putea reprezenta o alternativă off-the-shelf pentru celulele CAR-T – ar putea fi disponibilă spre achiziționare direct din farmacii, fără a fi nevoie de procesul complex de inginerie genetică personalizată din spatele CAR-T.
Terapia CAR-NK (sau FT596) ar putea elimina costul înalt și durata de săptămâni a procesului complex necesar pentru producerea terapiei celulare CAR-T, prin înlocuirea cu un produs obținut în masă, disponibil la raft. Astfel se va extinde accesul pacienților la imunoterapii celulare oncologice. Se preconizează că primele studii umane de fază I pentru tratamentul limfoamelor cu celule B și a leucemiei limfocitare cronice vor începe în acest an.
O altă celulă, rezultată din modificarea celulelor pacientului, este T-APC (limfocit T prezentator de antigene), care a demonstrat capacitatea de a stimula celulele CAR-T să persiste în sânge, să mențină un răspuns imunitar susținut și să prelungească remisiunea. Date noi din primul studiu clinic uman realizat pe un grup mic de pacienți a arătat că a doua infuzie de celule T ar putea preveni recăderile la pacienții care au fost tratați prin terapia CAR-T.
O altă mare provocare este dezvoltarea terapiilor CAR-T pentru tumorilor solide, care au o mare heterogenitate. Diferența semnificativă dintre tumorile solide și neoplasmele hematologice este provocarea identificării antigenelor potrivite. Majoritatea antigenelor care ar putea fi folosite drept ținte se află intracelular iar doar 1% dintre proteinele celulare sunt exprimate la suprafața celulelor neoplazice. Terapiile CAR-T nu pot interacționa cu antigene intracelulare.
Citește și:
- #BiotechWeek2020. Terapiile genice: cum a evoluat domeniul și care sunt cele mai importante lecții în ultimii 30 de ani?
- #BiotechWeek2020. Cum a evoluat domeniul genomicii și care sunt aplicațiile în practica medicală?
- #BiotechWeek2020. Medicamentele biologice: ultimele dezvoltări în domeniu și cele mai recente aprobări

