Secvențierea întregului exom crește acuratețea selectării pacienților care răspund la imunoterapie
Imunoterapiile au transformat tratamentul cancerelor în stadii avansate și în ultimii ani au demonstrat rezultate importante și în stadiile incipiente. Pacienții cu boală metastatică pot supraviețui mulți ani cu tratament bazat pe inhibitori ai punctelor de control (checkpoint inhibitors, CI), însă doar o minoritate din pacienții tratați demonstrează răspunsuri durabile. Având în vedere costul ridicat și toxicitatea potențială a acestor terapii, sunt necesari biomarkeri predictivi pentru tratmentul cu CI.
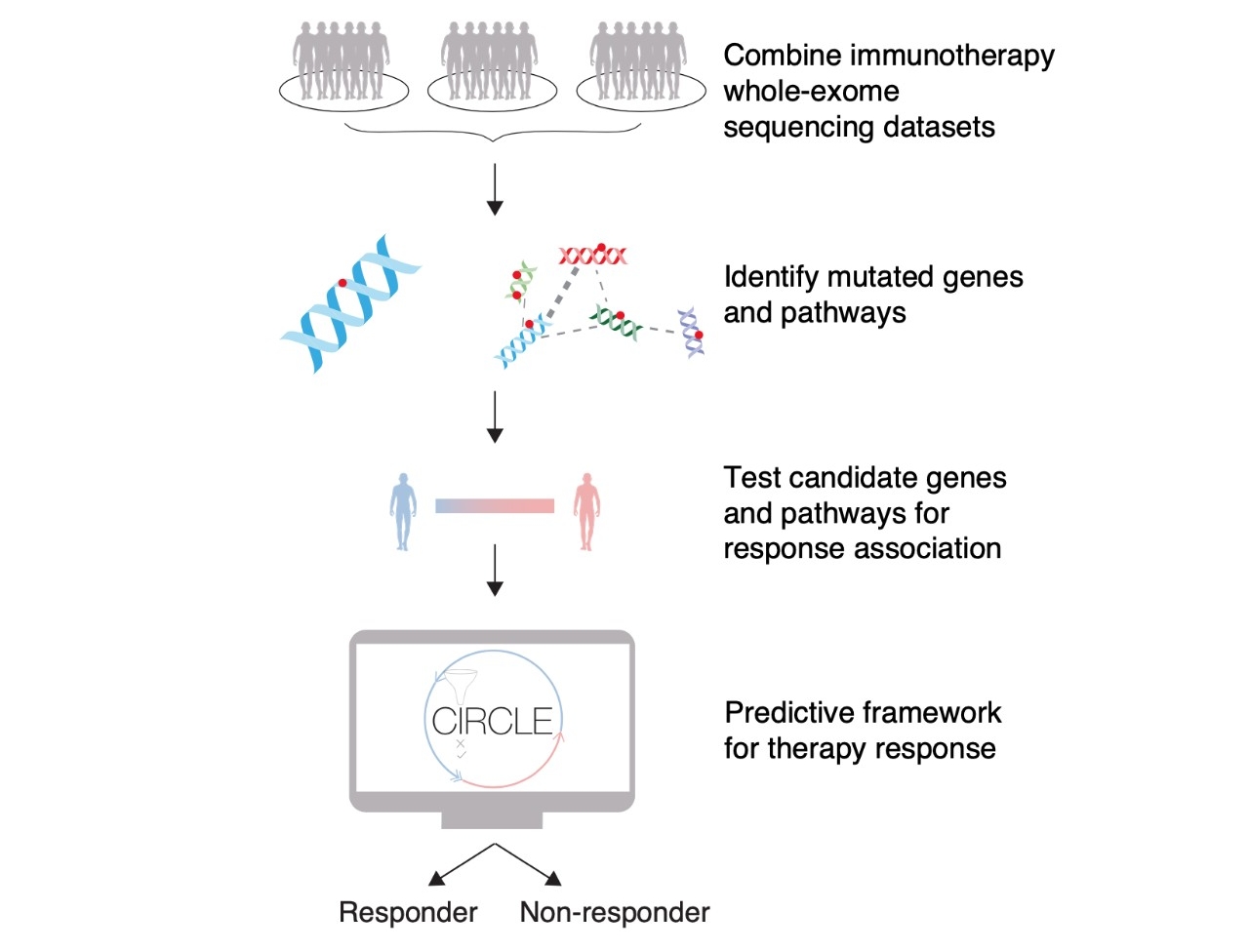
Biomarkerii folosiți în prezent pentru ghidarea tratmentului oncologic de tipul imunoterapiilor se bazează pe testarea unui număr relativ mic de gene (câteva sute) sau pe teste de imunohistochimie. În cadrul unui studiu realizat la Universitatea din New York s-a demonstrat utilitatea unui algoritm bazat pe testarea întregului exom (WES – whole exome sequencing), prin care sunt analizate genele care codifică proteine (în jur de 20.000 de gene), reprezentând aproximativ 2% din genom. Rezultatele au fost publicate în Nature.
Tumor mutation burden (TMB) este cel mai cunoscut biomarker pentru evaluarea răspunsului la tratamentul cu inhibitori ai punctelor de control și este folosit în cadrul testelor de diagnostic (FoundationOne CDx). Acesta se poate detecta prin secvențiere țintită sau prin secvențierea întregului exom, deși în practică se preferă prima variantă, având în vedere costurile asociate testării.
Însă, în cadrul studiului publicat în Nature, scopul a fost evaluarea unei regiuni mult mai mari din genom pentru a se identifica factori predictivi pentru răspunsul la imunoterapie. Au fost combinate date WES din 6 studii care au evaluat imunoterapii (de tipul anticorpilor anti-PD-1 sau anti-CTLA-4) la pacienți cu melanom, cancer pulmonar, cancer de vezică urinară, cancer de cap și gât.
Inițial au analizat datele obținute prin secvențiere pentru a se identifica regiuni cu o încărcătură mai mare de mutații. Folosind instrumentul FishHook s-au putut distinge mutațiile driver de alte tipuri de mutații care nu sunt relevante pentru carcinogeneză. Acesta colectează și alți factori care afectează rata mutațiilor (ex. dimensiunea genei, dacă o anumită regiune acumulează mutații mai frecvent sau nu). Astfel, s-au identificat 6 gene relevante, cu o încărcătură mutațională foarte înaltă.
Ulterior s-a testat dacă expresia acestor gene e diferită la persoanele care răspund sau nu la imunoterapie. Două dintre aceste gene, KRAS și BRAF erau supraexprimate la persoanele care răspundeau la imunoterapie. Genele TP53 și BCLAF1 erau supraexprimate la cei care nu răspundeau la imunoterapia cu inhibitori ai punctelor de control. De asemenea, datele sunt importante pentru informarea asupra rolului unor gene mai puțin studiate, cum ar fi BCLAF1, care ar putea fi integrate în panelurile multigenice folosite în oncologie în prezent. Rezultatele confirmă și cercetări anterioare, care arată rolul mutațiilor KRAS în rezistența la imunoterapie.
A urmat combinarea datelor despre cele 4 gene, alături de date despre diferite căi moleculare implicate în semnalizarea celulară (MAPK, TP53) și alte variabile predictive pentru răspunsul la imunoterapie (vârsta, tipul tumoral, încărcătura mutațională tumorală) pentru a se dezvolta un instrument de predicție numit CIRCLE (Cancer Immunotherapy Response CLassifiEr). Aceasta metodă a prezis răspunsul la imunoterapie cu o acuratețe cu până la 11% mai mare, comparativ cu simpla analiză a TMB. Prin metoda CIRCLE s-a stabilit și supraviețuirea după imunoterapie cu o acuratețe mult mai mare.
În continuare, testarea algoritmului CIRCLE trebuie extinsă pe un număr mult mai mare de pacienți pentru a valida utilitatea WES în practică.
Testarea genomică comprehensivă în oncologie
Accesibilitatea testării NGS de mare capacitate a permis dezvoltarea aplicațiilor testării genomice comprehensive (CGP), care implică detectarea simultană a tuturor claselor de modificări genomice (SNV, indels, CNV, fuziuni, markeri genomici – TMB, MSI) prin evaluarea a sute de gene într-un singur test, dintr-o singură probă. În tot mai multe centre se trece de la paneluri cu un număr limitat de exoni, la paneluri din ce în ce mai mari, inclusiv bazate pe date care pot fi obținute din testarea liniei germinale și secvențierea ARN. Ghidurile internaționale (NCCN, ESMO) recomandă deja testarea genomică comprehensivă pentru mai multe tipuri de cancere.
Prezența a numeroase gene cu mutații în celulele canceroase determină producția unor proteine modificate, care funcționează drept neoantigene și sunt recunoscute de către sistemul imun ca substanțe străine. Presupunerea că o povară ridicată a mutațiilor tumorale se asociază cu o imunogenicitate ridicată stă la baza folosirii TMB-H drept unul dintre cei mai importanți markeri pentru predicția răspunsului la imunoterapia cu inhibitori ai punctelor de control. Un studiu publicat în 2021 arată că TMB-H nu reprezintă însă, un biomarker universal care poate prezice răspunsul la imunoterapia cu inhibitorii punctelor de control (ICB, immune checkpoint blockade) la pacienții cu tumori solide. TMB-H a fost utilizat cu succes ca biomarker predictiv doar într-un subgrup al populației incluse în studiu: tipurile de cancer în care numărul de limfocite T CD8 pozitive (CD8+) se corelează cu TMB-H. În cazul altor categorii de tumori, nu a fost identificată o asociere cu rezultate favorabile în urma administrării ICB.
Deși testarea unor paneluri de sute de gene se realizează de rutină în oncologie, studiul actual demonstrează importanța unor testări din ce în ce mai ample, fie testarea întregului exom sau chiar a genomului, pentru a rafina clasificarea pacienților și a anticipa răspunsul la noile tipuri de terapii. Această strategie crește șansele de a se identifica modificări acționabile și reduce costurile și riscurile asociate unei noi biopsii.

Pe plan internațional se observă o creștere importantă a numărului de terapii țintite și imunoterapii aprobate pentru a trata cancerele în funcție de prezența biomarkerilor. Cu toate acestea, există o lipsă de claritate cu privire la momentul recomandării secvențierii genomului tumoral, la ce tip de teste ar trebui recomandate și interpretarea rezultatelor pentru selectarea tratamentului. Societatea Americană de Oncologie Clinică (ASCO) a reunit un comitet de experți pentru a genera recomandări cu privire la utilizarea secvențierii genomice pentru informarea deciziilor cu privire la terapiile oncologice pentru cancerele solide avansate/metastatice. ASCO încurajează oncologii să folosească de rutină testarea genomică pentru pacienții cu tumori solide avansate. Se recomandă testarea multigenică și nu testarea secvențială de biomarkeri.
Citește și:
- Etapa genomului uman de 100$ este deja o realitate. Care sunt noile tehnologii de secvențiere ce ar putea revoluționa medicina?
- Noi recomandări ASCO: testarea genomică somatică ar trebui să fie parte din standardul clinic pentru tumorile solide avansate

