
Ce sunt anticorpii monoclonali?
O modalitate a sistemului imunitar de a ataca structurile străine (bacterii, virusuri, fungi, paraziți) este de a produce un număr mare de anticorpi, care vizează proteinele „intrusului”, numite antigene. Anticorpii circulă prin sânge, străbătând tot corpul până când găsesc antigenul specific, la care se atașează și pe care îl marchează, semnalând celulelor sistemului imunitar că este o structură străină care trebuie distrusă.
Această particularitate a anticorpilor, de a recunoaște proteinele străine și de a se fixa pe ele, făcându-le „ținte” pentru acțiunea sistemului imunitar, îi face un instrument util în tratamentul a numeroase tipuri de cancer și nu numai. În ultimii ani, tot mai multe medicamente bazate pe anticorpi monoclonali (mabs) au fost aprobate sau se află în studii clinice.
Anticorpii monoclonali sunt anticorpi identici, obținuți în laborator din aceeași linie de celule și care recunosc același antigen. Aceștia sunt creați în așa fel încât să se atașeze de proteine care se găsesc pe suprafața celulelor canceroase, dar nu și pe celulele normale. În plus, la anticorpii monoclonali se pot atașa medicamente împotriva cancerului, care vor fi astfel transportate exact la nivelul tumorii.
De când se cercetează anticorpii monoclonali?
În 1975 a fost publicată prima lucrare care a descris tehnica hibridomului, o metodă de generare a unor cantități mari de anticorpi monoclonali cu o specificitate predefinită. Metoda a revoluționat cercetarea medicală și a permis generarea unui număr semnificativ de terapii pentru multe tipuri de boli. Începând cu anul 2006, FDA aproba anual anticorpi monoclonali. În 2019 anticorpii reprezentau 9 din 20 top terapii de pe piață. Astăzi, sunt cel puțin 10 aprobări pe an. În 2021, FDA marchează a 100-a aprobare a unui anticorp monoclonal (dostarlimab, cu indicație în cancerul endometrial).
Anticorpii monoclonali în oncologie
Permit sistemului imunitar să distrugă celulele canceroase. Sistemul imunitar nu recunoaște întotdeauna celulele canceroase ca fiind dăunătoare. Atunci când un anticorp monoclonal se atașează la acestea și le marchează, devine mai ușor pentru sistemul imunitar să le găsească și să le distrugă.
Previn creșterea rapidă a celulelor canceroase. Creșterea celulelor organismului este stimulată de substanțe numite factori de creștere, care se atașează la receptori de pe suprafața celulelor și le dictează acestora să crească și să se înmulțească. Unele celule canceroase produc un număr mai mare de receptori pentru factorul de creștere, astfel încât cresc mai repede decât celulele normale. Anticorpii monoclonali pot bloca acești receptori, prevenind transmiterea semnalului de creștere. De exemplu, anticorpul trastuzumab limitează creșterea celulelor canceroase, în cancerul de sân și cancerul de stomac, legându-se de proteina HER2.
Fac posibilă iradierea țintită a celulelor neoplazice. Acest tratament, numit radio imunoterapie, folosește anticorpi monoclonali la care sunt atașate particule mici radioactive, pe care le transportă direct la celulele canceroase. De exemplu, ibritumomab tiuxetan este anticorp monoclonal radiomarcat care se fixează de antigenul CD20 de pe suprafața limfocitelor B, fiind folosit în tratamentul limfomului non-Hodgkin.
Transportă medicamente direct la celulele canceroase. La anticorpul monoclonal se pot atașa substanțe chimioterapice, iar aceștia se vor fixa de celulele canceroase, unde medicamentul acționează fără a afecta celulele sănătoase. Un asemenea medicament este trastuzumab-etamsin folosit în cazul pacientelor cu cancer de san HER2 pozitiv. De asemenea, vedotin brentuximab este format dintr-un anticorp care țintește antigenul CD30 (găsit pe limfocite), la care este atașat un medicament chimioterapic numit MMAE. Acest medicament este folosit pentru a trata limfomul Hodgkin și limfomul anaplazic cu celule mari.
Anticorpii monoclonali bispecifici combină elemente de la doi anticorpi, o parte atașându-se la celula canceroasă, în timp ce cealaltă se atașează la celule ale sistemului imunitar, conducând la declanșarea răspunsului imun. Un exemplu este blinatumomab, care este utilizat la pacienții cu leucemie limfocitară acută. O parte se atașează la proteina CD19, care se găsește pe unele celule leucemice și din limfom. O altă parte se atașează la CD3, proteină de pe suprafața unor celule ale sistemului imunitar numite limfocite T. Astfel, medicamentul aduce celulele canceroase și celulele responsabile cu imunitatea împreună, astfel încât sistemul imunitar să atace celulele canceroase.
Ce anticorpi monoclonali se folosesc în tratamentul Covid-19?
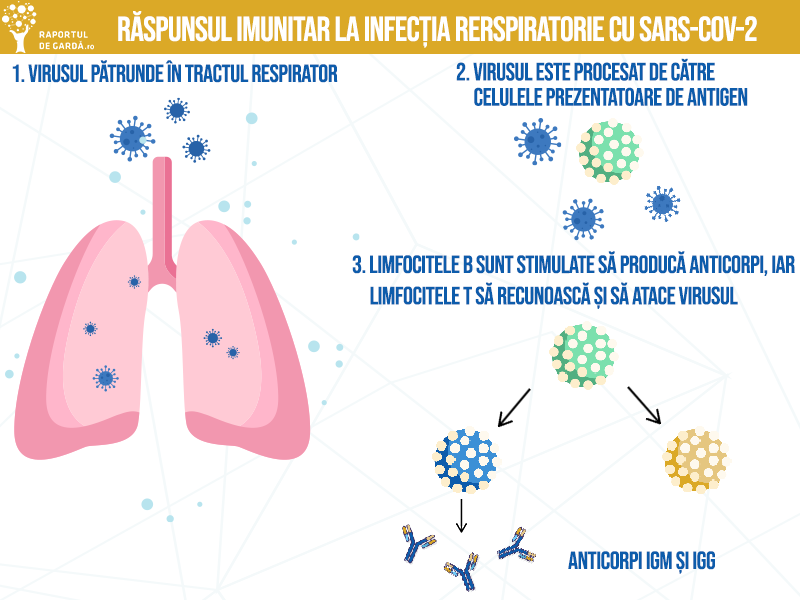
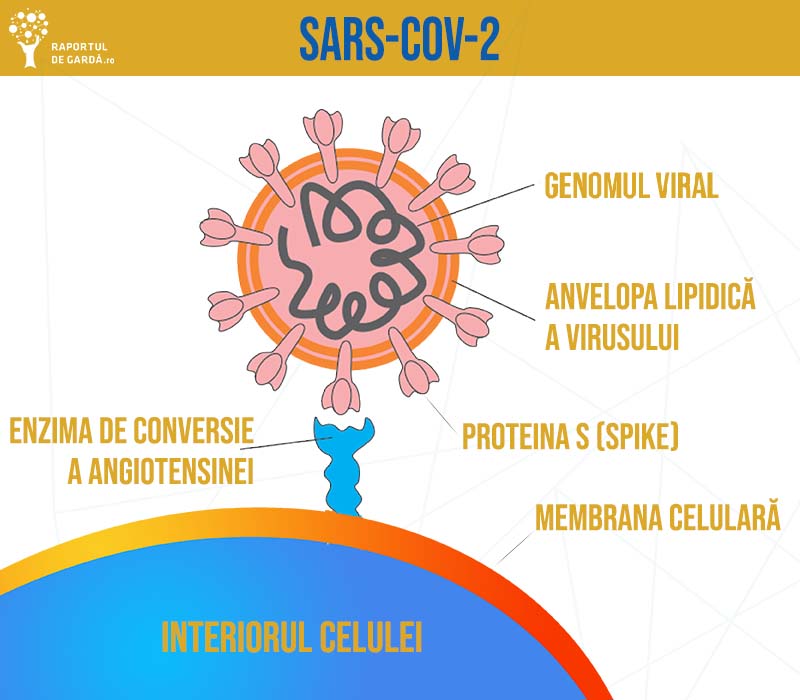
Anticorpii monoclonali reprezintă una dintre clasele terapeutice folosite în tratamentul COVID-19 (fie anticorpi monoclonali antivirali, care se utilizează în stadiile incipiente ale bolii, fie anticorpi monoclonali cu rol de imunomodulatori, utilizați în cazurile grave, spitalizate). Anticorpi monoclonali antivirali sunt direcționați împotriva unei ținte specifice și pot restabili, îmbunătăți sau imita acțiunile sistemului imunitar natural împotriva SARS-CoV-2. Anticorpii monoclonali autorizați în prezent pentru tratamentul COVID-19 în sistem de urgență vizează proteina spike a SARS-CoV-2, pe care virusul o folosește pentru a pătrunde în celulele gazdei.
În prezent, trei anticorpi monoclonali dețin autorizație FDA de utilizare de urgență (EUA) în Statele Unite ale Americii:
- Bamlanivimab plus etesevimab – doi anticorpi monoclonali utilizați în combinație (autorizați EUA în februarie 2021, revizuiți în septembrie 2021);
- Casirivimab plus imdevimab – doi anticorpi monoclonali utilizați împreună (autorizați în noiembrie 2021, revizuiți apoi în iulie 2021);
- Sotrovimab (autorizat EUA în mai 2021).
Pe lângă aceștia, un singur anticorp monoclonal (Tocilizumab) este disponibil pentru utilizare la pacienții spitalizați cu COVID-19 începând cu iunie 2021. Tocilizumab este un anticorp monoclonal care reduce inflamația prin blocarea receptorului interleukinei-6. În cazul infecției COVID-19, sistemul imunitar poate deveni hiperactiv, ceea ce poate duce la agravarea bolii. Actemra nu acționează direct asupra SARS-COV-2.
Acestea sunt medicamente aflate în proces de cercetare și nu sunt în prezent aprobate pentru introducerea pe piață. Eliberarea unei autorizații de utilizare de urgență nu constituie aprobare FDA.
La sfârșitul lunii octombrie, Comisia Europeană a stabilit un portofoliu al celor mai promițătoare 10 tratamente pentru COVID-19, cu șanse de a fi aprobate și de a deveni disponibile la nivelul Uniunii Europene. Momentan, la nivelul UE nu există niciun anticorp monoclonal aprobat condiționat (echivalentul aprobării de urgență – EUA) pentru tratamentul Covid-19, însă multiple astfel de tratamente se află în curs de aprobare:
- Regkirona (regdanvimab);
- RoActemra (tocilizumab), care deține autorizație de comercializare pentru tratamentul altor boli;
- Ronapreve (casirivimab / imdevimab);
Totuși, Agenția Europeană a Medicamentului a publicat ghiduri pentru utilizarea de către statele membre în afara autorizației condiționate:
- Bamlanivimab / etesevimab
- Casirivimab / imdevimab
- Regdanvimab
- Sotrovimab
În curs de revizuire accelerată în UE se află următoarele medicamente:
- Evusheld (tixagevimab / cilgavimab)
- Sotrovimab
Combinația bamlanivimab plus etesevimab
Sunt anticorpi monoclonali IgG1 neutralizanți care se leagă de epitopi diferiți, dar suprapusi, de la nivelul domeniului de legare la receptorul proteinei spike a SARS-CoV-2. FDA a extins EUA pentru a include utilizarea ca profilaxie post-expunere pentru anumite persoane care nu sunt complet vaccinate sau este posibil să nu dezvolte un răspuns imunitar adecvat la vaccinarea completă SARS-CoV-2, au risc ridicat de dobândire a infecției cu SARS-CoV-2 și prezintă risc crescut de a evolua către o boală severă în cazul infectării. Profilaxia post-expunere NU are rolul de a înlocui vaccinarea împotriva COVID-19 și NU este autorizată pentru profilaxia pre-expunere în scopul prevenirii COVID-19. Anticorpii monoclonali se administrează numai împreună, sub formă de perfuzie intravenoasă.
Combinația casirivimab și imdevimab
Sunt anticorpi monoclonali umani recombinați, de tip IgG1, care țintesc în mod specific domeniul cu proprietăți de legare de receptor a proteinei spike de la suprafața virusului SARS-CoV-2. FDA a extins EUA pentru a include utilizarea ca profilaxie post-expunere pentru anumite persoane care nu sunt complet vaccinate sau este posibil să nu dezvolte un răspuns imunitar adecvat la vaccinarea completă SARS-CoV-2, au risc ridicat de dobândire a infecției cu SARS-CoV-2 și prezintă risc crescut de a evolua către o boală severă în cazul infectării. Anticorpii monoclonali pot fi administrați numai împreună, ca perfuzie intravenoasă sau sub formă de patru injecții subcutanate, doar dacă administrarea intravenoasă nu este posibilă sau ar duce la o întârziere a tratamentului.
Sotrovimab
Este un anticorp monoclonal umanizat recombinant de tip IgG1κ, care vizează un epitop al domeniului de legare la receptor al proteinei spike a SARS-CoV-2. Se administrează sub formă de perfuzie intravenoasă.
Această decizie s-a bazat pe rezultatele studiului REGN-COV 2069, în cadrul căruia combinația terapeutică a fost administrată la persoane care au intrat în contact, în gospodărie, cu persoane cu infecție confirmată:
- Riscul de a dezvolta infecție simptomatică a fost cu 81% mai mic;
- În cazul pacienților care au dezvoltat infecție simptomatică, manifestările s-au remis în aproximativ o săptămână, față de 3 săptămâni în cadrul grupului placebo.
Tocilizumab
Este un anticorp monoclonal umanizat recombinant care se leagă selectiv la receptorii IL-6 (sIL-6R și mIL-6R) și, ulterior, inhibă semnalizarea mediată de IL-6 prin acești receptori. Este recomandat pacienților adulți și pediatrici (peste vârsta de 2 ani) internați cu COVID-19, care primesc corticoterapie sistemică și care necesită oxigen suplimentar, ventilație mecanică noninvazivă / invazivă sau ECMO.
Se administrează sub formă de perfuzie intravenoasă. Tocilizumab este aprobat de FDA pentru mai multe indicații, însă nu este încă aprobat pentru tratamentul COVID-19.
Anticorpii monoclonali care au solicitat autorizație EMA de introducere pe piață:
Regdanvimab: Comitetul pentru medicamente de uz uman (CHMP) al EMA a concluzionat că regdanvimab poate fi utilizat pentru tratamentul formelor ușoare-moderate de COVID-19 la pacienții adulți cu risc crescut de a evolua către o formă severă.
Tocilizumab: În luna august, EMA a început evaluarea tocilizumab pentru a-i extinde utilizarea în tratamentul pacienților adulți internați cu forme severe de COVID-19.
Casirivimab plus imdevimab: CHMP al EMA a concluzionat că această combinație de anticorpi monoclonali poate fi utilizată pentru tratamentul COVID-19. În paralel, începând cu luna februarie, se desfășoară o revizuire continuă a combinației terapeutice.
Anticorpii monoclonali aflați în curs de revizuire continuă de către EMA:
Tixagevimab plus cilgavimab: Cei doi anticorpi monoclonali se atașează de proteina spike a SARS-CoV-2, împiedicând pătrunderea virusului în celulele organismului. Utilizarea celor doi în combinație este mai eficientă deoarece anticorpii se atașează la nivelul unor diferite părți ale proteinei spike. CHMP a început revizuirea continuă a combinației pentru prevenirea infecției COVID-19 la adulți.
Sotrovimab: Comitetul pentru medicamente de uz uman al EMA a concluzionat că sotrovimab poate fi utilizat pentru a trata COVID-19. Recomandările EMA pot fi acum utilizate pentru a sprijini decizia de utilizare a acestui anticorp monoclonal înainte de eliberarea unei autorizații de introducere pe piață. În luna mai a început procesul de revizuire continuă a sotrovimab, aflat în desfășurare. Odată finalizată, revizuirea continuă va sta la baza unei cereri de autorizare de introducere pe piață europeană a acestui medicament.
Până la sfârșitul lunii octombrie a acestui an, în proces de evaluare continuă se afla și combinația de anticorpi monoclonali, bamlanivimab plus etesevimab, după ce CHMP concluzionase că asocierea poate fi utilizată pentru tratamentul COVID-19. Agenția a analizat, de asemenea, utilizarea bamlanivimab în monoterapie și a concluzionat că, în ciuda incertitudinilor legate de beneficiile monoterapiei, acesta poate fi considerat o opțiune de tratament. Cu toate acestea, EMA a încheiat revizuirea continuă a bamlanivimab plus etesevimab, după ce compania producătoare (Eli Lilly) a informat retragerea din proces. În scrisoarea de notificare a agenției europene, compania a declarat că se retrage deoarece CHMP a solicitat date de validare care puteau fi generate numai prin producerea a noi loturi de substanță activă care nu era necesară pe baza previziunilor de aprovizionare a companiei.
Articole despre anticorpi monoclonali:

Esențial COVID-19: cele mai importante știri ale săptămânii. Varianta B.1.1.7 a SARS-CoV-2 ar putea fi cu până la 70% mai letală decât tulpina originală
Accesează Esențial Covid-19 Știrile săptămânii 08-14 feb. 2021: CDC: Purtarea a două măști de protecție reduce răspândirea SARS-CoV-2 Utilizarea a două măști de protecție și asigurarea faptului că masca se potrivește perfect pe față poate reduce semnificativ riscul de expunere la SARS-CoV-2, conform experimentelor de laborator efectuate de autoritățile sanitare din SUA. În luna ianuarie, CDC […]

Esențial COVID-19: FDA autorizează de urgență vaccinul Moderna și primul test de antigen care poate fi utilizat la domiciliu pentru diagnosticare rapidă
Accesează Esențial Covid-19 Știrile săptămânii 14-20 decembrie 2020: FDA autorizează în regim de urgență vaccinul Moderna împotriva COVID-19 Vaccinul împotriva COVID-19 produs de compania Moderna este aprobat pentru utilizare de urgență de către Food and Drug Administration (FDA). Vaccinul utilizează aceeași tehnologie de tip ARN mesager precum primul vaccin aprobat, cel produs de Pfizer și BioNTech, și […]

Săptămâna Europeană a Biotehnologiei 2019: Simpozionul „Valoarea adăugată a biotehnologiei și medicamentelor biologice în sistemul de sănătate din România”
În următorii ani se așteaptă ca jumătate dintre medicamentele produse în întreaga lume să fie obținute cu ajutorul biotehnologiei. Și în România, medicamentele biologice se regăsesc din ce în ce mai des printre opțiunile terapeutice din multe specialități medicale. Săptămâna Europeană a Biotehnologiei a fost marcată în cadrul Conferinței de Medicină Personalizată, care a inclus […]

Istoricul tratamentelor pentru cancer: de la chimioterapie, la dezvoltarea terapiilor CAR-T
Cancerul este o boală ce a afectat omenirea dintotdeauna, iar domeniul oncologic este atât de vast încât putem spune că valorifică cea mai mare parte dintre cunoștințele acumulate până acum despre corpul uman, de către omenire. Însă și metodele de tratament au evoluat permanent, iar astăzi avem terapii sofisticate și eficiente, precum CAR (Chimeric Antigen […]

Hemlibra – Tratamentul pentru hemofilia A cu inhibitori a fost aprobat în UE
Comisia Europeană a aprobat Hemlibra, un nou medicament profilactic destinat pacienților cu hemofilie A, care prezintă inhibitor de factor VIII. Hemlibra este primul astfel de medicament aprobat în Uniunea Europeană în ultimii 10 ani. Comisia Europeană a aprobat Hemlibra pe baza a două studii clinice în cadrul cărora produsul a demonstrat eficiență superioară comparativ cu […]

Ixekizumab, primul tratament care poate induce o remisiune completă a psoriazisului în plăci, compensat în România
Pe 20 ianuarie, aproximativ o sută de medici specialiști dermatologi s-au reunit la București pentru a dezbate noutățile din domeniul conduitei terapeutice asociate psoriazis-ului. Evenimentul a marcat și lansarea în România a ixekizumab (Taltz), primul tratament biologic care poate induce o remisiune completă a psoriazisului în plăci. Informații cheie: psoriazis este o afecțiune puțin înțeleasă de […]

Ocrelizumab, primul tratament pentru scleroza multiplă rapid progresivă, aprobat în UE
Comisia Europeană a aprobat anticorpul monoclonal ocrelizumab, primul tratament pentru scleroza multiplă recurent remisivă și scleroza multiplă primar progresivă. Aprobarea ocrelizumab a avut la bază rezultatele unei serii de studii de fază III care au arătat superioritatea medicamentului în comparație cu tratamentele cu interferon. Scleroza multiplă (SM) afectează aproximativ 700.000 de europeni, dintre care 96.000 […]

#ASCO2017: Pertuzumab adăugat terapiei adjuvante standard crește supraviețuirea în cancerul mamar HER-2 pozitiv cu risc înalt (Studiul APHINITY)
Încă un blocant HER-2 (pertuzumab) adăugat în terapia adjuvantă poate reduce cu 19% riscul de cancer mamar invaziv și crește supraviețuirea la femeile cu tumoră HER-2 pozitivă, fără receptori hormonali și cu celule canceroase prezente în ganglionii limfatici, se arată în studiul prezentat la Congresul Societății Americane de Oncologie Clinică. APHINITY este un studiu clinic […]

#ASCO2017: Testarea genomică de rutină este fezabilă, dar numai o parte a pacienților beneficiază de ea în mod curent
Studiul ProfiLER, realizat în Franța pe un număr de 1.944 de pacienți care aveau cancer în stadiu avansat, sugerează că accesul la testarea genomică de rutină este fezabil, chiar dacă în momentul actual doar un număr redus de pacienți se bucură de beneficiile ei clinice. Potrivit realizatorilor, este cel mai mare studiu de acest fel întocmit până […]

