FDA a aprobat pembrolizumab împreună cu testul FoundationOne CDx, pentru tumorile solide care prezintă markerul TMB-H, indiferent de localizare
FDA (U.S. Food and Drug Administration) a aprobat FoundationOne®CDx ca un test diagnostic de însoțire pentru Keytruda (pembrolizumab), care a fost, de asemenea, aprobată accelerat pentru tratamentul pacienților adulți și pediatrici cu tumori solide nerezecabile sau metastatice, cu încărcătură mutațională mare (TMB-H) [≥10 mutații/megabase (mut / Mb)], care au progresat în urma tratamentului prealabil și care nu au opțiuni alternative de tratament. FoundationOne CDx este primul și singurul mijloc diagnostic de însoțire aprobat de FDA pentru a măsura incărcătura de mutații a tumorii (TMB) și pentru a ajuta la identificarea pacienților adecvați pentru tratamentul cu Keytruda, indiferent de tipul tumorii solide.
TMB este o măsură a numărului de mutații somatice per regiune codificatoare din genomul unei tumori. Această semnătură genomică poate ajuta la determinarea probabilității unui pacient de a răspunde la imunoterapii. FoundationOne CDx este un test complet de profilare genomică (CGP) aprobat pentru toate tumorile solide, care permite oncologilor să identifice pacienții cu TMB-H (≥ 10 mutații / megabase) cu tumori solide nerezecabile sau metastatice din rândul tuturor tipurilor de tumori care ar putea beneficia de Keytruda (pembrolizumab).

„Imunoterapia revoluționează tratamentul cancerului. Nu numai că această aprobare înseamnă că medicii clinicieni vor putea identifica mai mulți pacienți care ar putea beneficia de această opțiune de tratament, dar este o etapă importantă în trecerea către punerea la dispoziția pacienților a terapiilor agnostice tumorale, bazate pe biomarkeri, ceea ce este posibil printr-o metodă diagnostică aprobată de FDA”, a declarat Prof. Dr. Brian Alexander, chief medical officer la Foundation Medicine.
FoundationOne CDx este primul test complet de profilare genomică (CGP) aprobat de FDA care este validat clinic și analitic pentru toate tumorile solide și poate fi folosit în ajutorul identificării pacienților adecvați pentru mai multe terapii. În prezent este aprobat ca test de diagnostic însoțitor pentru mai mult de 20 de terapii pentru mai multe tipuri de cancer.
„Această aprobare reprezintă o schimbare de paradigmă către tratamentul cancerului bazat pe biomarkeri”, a declarat Jeff Allen, președinte și CEO al Friends of Cancer Research. „TMB oferă un instrument suplimentar pentru informarea îngrijirii medicale clinice, în special pentru bolnavii de cancer anterior neeligibili pentru imunoterapie pe baza biomarkerilor existenți.”
Compania farmaceutică Merck a anunțat, de asemenea, că FDA a aprobat cererea suplimentară de licență pentru medicamente biologice (sBLA) pentru Keytruda, pentru pacienții adulți și pediatrici cu tumori solide nerezecabile sau metastatice cu o încărcătură mutațională mare (TMB-H), determinată printr-un test aprobat de FDA, care au progresat după tratamentul prealabil și care nu au opțiuni alternative de tratament.
Aprobarea accelerată a pembrolizumab s-a bazat pe o analiză prospectivă planificată și retrospectivă a studiului clinic deschis KEYNOTE-158, care a utilizat un test aflat în studiu clinic (CTA), bazat pe FoundationOne CDx, pentru a determina statusul TMB al țesutului tumoral al pacienților. Rezultatele au arătat că pacienții cu tumori solide cu TMB-H (≥ 10 mutații / megabase) care au fost tratați cu Keytruda au avut o rată globală de răspuns mai mare (29%), ceea ce înseamnă că au înregistrat o reducere de cel puțin 30% a dimensiunii tumorale, inclusiv unele tumori au dispărut complet. În schimb, doar 6% dintre pacienții fără biomarkerul TMB-H au prezentat un răspuns la pembrolizumab. În cazul a jumătate dintre participanții care au răspuns la tratament, tumorile nu au reînceput să crească imp de cel puțin 2 ani.
Keytruda (pembrolizumab) este o imunoterapie anti-PD-1 care acționează prin creșterea capacității sistemului imunitar al organismului de a detecta și distruge celule tumorale. Keytruda este acum aprobată pentru două indicații tumor-agnostic. În 2017, pembrolizumab a primit aprobarea FDA ca primul tratament oncologic bazat pe o semnătură genomică, indiferent de tipul cancerului, în tumorile solide cu instabilitate microsatelitară înaltă (MSI-H) sau cu deficiențe de reparare a ADN-ului (dMMR). Cei doi biomarkeri, MSI-H și TMB-H sunt înrudiți, majoritatea tumorilor MSI-H prezentând și TMB crescut. Opusul însă nu este adevărat – multe tumori TMB-H nu sunt și MSI-H.
Mai mult decât atât, statusul MSI nu trebuie neapărat să fie stabilit prin secvențiere extensivă a tumorilor, în timp ce în general, statusul TMB trebuie verificat. Astfel, o aprobare a medicamentului bazată pe TMB este importantă, deoarece biomarkerul TMB-H este mai frecvent în tumori, comparativ cu MSI-H.
În studiul KEYNOTE-158, majoritatea pacienților cu tumori TMB-H nu a beneficiat de tratamentul cu pembrolizumab și un procent mic de pacienți ale căror tumori au avut TMB scăzut au răspuns la tratament. Acest lucru sugerează că mai sunt încă lucruri de aflat și de învățat pentru a putea prezice ce pacienți vor răspunde la medicamentele imunoterapice. Există dovezi, de exemplu, că gradul TMB necesar pentru a îmbunătăți probabilitatea de răspuns la imunoterapie poate varia de la cancer la cancer.
Mai multe despre FoundationOne CDx
FoundationOne CDx este un dispozitiv de diagnosticare bazat pe secvențiere de nouă generație, pentru detectarea alterațiilor de substituție, a inserțiilor și a delețiilor, a alterațiilor numărului de copii (CNA) din 324 de gene, a anumitor rearanjamente genice, precum și semnături genomice, incluzând instabilitatea microsatelitară ( MSI) și sarcină mutațională tumorală (TMB), folosind ADN-ul izolat din mostre de țesut tumoral încorporat cu formalină fixă în parafină (FFPE).

FoundationOne CDx este destinat numai utilizării pe bază de rețetă și este conceput ca un test diagnostic de însoțire pentru a identifica pacienții care pot beneficia de tratament cu anumite terapii țintite în conformitate cu eticheta aprobată a produsului terapeutic.
În plus, FoundationOne CDx este conceput să ofere profilul mutației tumorii pentru a fi utilizat de către profesioniștii din domeniul medical, în conformitate cu ghidurile profesionale din oncologie, pentru pacienții cu neoplazii maligne solide. Utilizarea testului însă nu garantează că unui pacient îi va fi găsit un tratament corespunzător, iar un rezultat negativ nu exclude prezența unei modificări (alterări genice). Unii pacienți ar putea necesita biopsie pentru diagnostic.
Este important de subliniat faptul că statusul TMB este doar o informație despre tumoră. Relevanța acestui biomarker pentru tratament poate depinde de o serie de factori, inclusiv capacitatea fizică a pacientului și disponibilitatea de a tolera un tratament suplimentar.
Ce reprezintă TMB?
Încărcătura mutațională a tumorii (TMB) este o măsură a numărului total de mutații per aria de codificare a unui genom tumoral. TMB este o semnătură genomică suplimentară, similară cu un biomarker, care poate ajuta la identificarea mai multor candidați (pacienți) care pot beneficia de imunoterapie pentru o gamă largă de tipuri de tumori. Nivelurile sunt măsurate în funcție de numărul de mutații nemoștenite (dobândite) care apar per megabase (1 milion de perechi de baze ADN) ale genomului tumorii. Niveluri mai mari de TMB sunt corelate cu niveluri mai mari de neoantigene, care ajută sistemul imunitar să recunoască și să atace celulele canceroase. TMB poate fi măsurat pe baza unor teste genomice comprehensive ale unor probe sanguine sau de țesut.
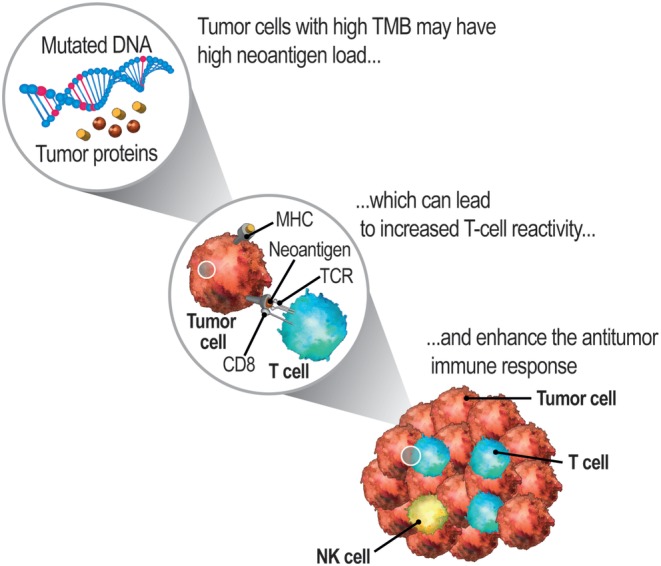
Încărcătura mutațională a tumorii (TMB) variază în funcție de tipul tumorii, precum și în rândul pacienților. Pentru unele tumori, în special pentru cele cu TMB înalt, cum ar fi melanomul și cancerul pulmonar, există dovezi pentru asocierea TMB cu numărul neoantigenelor. Neoantigenele sunt epitopi noi de suprafață ai celulelor tumorale, unele dintre ele putând fi recunoscute drept străine organismului de către sistemul imunitar, ceea ce duce la o reactivitate crescută a celulelor T și duce astfel la un răspuns imun antitumoral.
Apariția imunoterapiilor se află în strânsă legătură cu cercetările asupra biomarkerilor, precum: instabilitatea microsatelitară înaltă (MSI-H, care a fost aprobată de către FDA drept biomarker), sau încărcătura mutațională înaltă (TMB, care este în curs de validare), etc. Analiza încărcăturii mutaționale a tumorilor (TMB) și a instabilității microsatelitare (MSI) reprezintă baza deciziilor terapeutice privind imunoterapiile împotriva cancerului și ar trebui să devină parte din diagnosticul de rutină în terapia oncologică. Mai multe informații despre modul în care testarea genomică și biomarkerii au schimbat standardul european în managementul cancerului, puteți afla din raportul „Comparator Report on Cancer in Europe 2019”, realizat de către IHE (The Swedish Institute for Health Economics).

