FDA aprobă risdiplam, primul tratament administrat oral pentru atrofia musculară spinală
Risdiplam (Evrysdi, Roche și PTC Therapeutics) este prima terapie cu administrare orală pentru atrofia musculară spinală (AMS), indicată în cazul adulților și copiilor cu vârsta mai mare de 2 luni, aprobată de Food and Drug Administration (FDA). Risdiplam reprezintă una dintre puținele opțiuni terapeutice pentru atrofia musculară spinală. În prezent, moleculele cu indicație în AMS sunt Zolgensma (onasemnogene abeparvovec-xioi), prima terapie genică indicată în atrofia musculară spinală pentru copii cu vârste mai mici de 2 ani și Spinraza (nusinersen), prima terapie modificatoare de boală aprobată în 2016 de FDA pentru tipurile I-III de AMS.
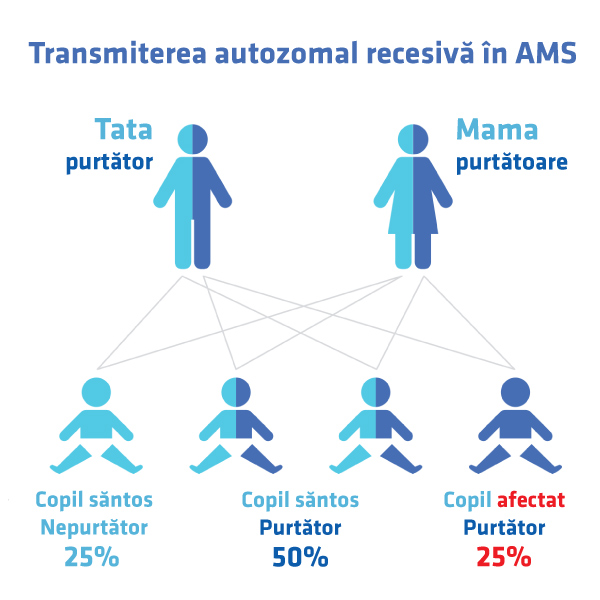
Atrofia musculară spinală este o boală genetică rară caracterizată prin deficitul de proteină SMN (Survival Motor Neuron), codificată de genele SMN1 și SMN2. Disfuncția proteinei SMN determină atrofie musculară prin distrugerea neuronilor motori. Anomalile genei SMN1 determină obținerea unei proteine incomplete sau nefuncționale. Acest deficit poate fi parțial compensat de gena SMN2. Numărul genelor SMN2 variază la fiecare persoană, însă cu cât sunt exprimate mai multe copii, cu atât se va produce o cantitate mai mare de proteină și boala va avea o formă mai ușoară.
Eficiența tratamentului cu risdiplam a fost evaluată în 4 studii clinice, FIREFISH, SUNFISH, JEWELFISH și RAINBOWFISH. Aprobarea medicamentului a survenit în urma rezultatalor studiilor FIREFISH și SUNFISH, care au analizat evoluția pacienților diagnosticați cu AMS de tip I (forma severă infantilă, boala Werdnig-Hoffmann) și respectiv, AMS de tip II (forma intermediară, infantilă cronică) sau AMS de tip III (forma uşoară, juvenilă, boala Kugelberg-Welander).
Studiul FIREFISH a inclus 21 de participanți cu vârste cuprinse între 1 și 7 luni, diagnosticați cu atrofie musculară spinală tip I și la care au fost identificate 2 copii ale genei SMN2. Risdiplam a fost administrat zilnic, timp de 4 săptămâni, în doze diferite. Datele obținute au relevat următoarele aspecte:
- 41% dintre pacienți au reușit să stea in șezut mai mult de 5 secunde fără suport la 12 luni de tratament;
- 81% dintre pacienți au supraviețuit după 23 de luni de tratament fără a necesita ventilație mecanică;
- proteina SMN a înregistrat o creștere de 6,5 ori la pacienții care au primit tratament cu risdiplam, față de nivelul de bază.
Beneficiile tratamentului cu risdiplam pentru AMS de tip II și III au fost evaluate concomitent în cadrul studiului dublu-orb SUNFISH, desfășurat în 2 etape. În prima etapă s-a stabilit doza optimă de administrare a medicamentului, urmând ca în etapa II să fie analizată eficiența tratamentului cu risdiplam. Cea de a 2-a parte a studiului a inclus 180 de pacienți cu vârste cuprinse între 2 și 25 de ani, cu diagnostic de AMS tip II sau III. Obiectivul principal a constat în măsurarea funcției motorii cu ajutorul scalei Motor Function Measure 32 (MFM-32) după 1 an de tratament cu risdiplam, comparativ cu administrarea de placebo. Rezultatele au fost următoarele:
- Cei care au primit risdiplam au înregistrat o creștere de 1.36 ori mai mare a funcției motorii comparativ cu grupul placebo, unde pacienții au avut funcția motorie redusă față de punctul de plecare;
- Cel mai bun răspuns la tratament conform MFM-32 a fost observat în grupul de pacienți tineri (2-5 ani);
- 57,1% dintre pacienții în grupa de vârstă 18-25 de ani au stagnat sub tratamentul cu risdiplam, fără a înregistra o progresie a deficitului motor, comparativ cu doar 37,5% din grupul de placebo.
Dr. Stuart W. Peltz, CEO al PTC Therapeutics, a declarat că risdiplam are potențialul de a deveni cel mai competitiv medicament la nivel global în ceea ce privește tratamentul pacienților cu AMS.
“Terapiile aprobate până în prezent se adresează unei populații restrânse dintre cei diagnosticați cu atrofie musculară spinală. Studiul SUNFISH este primul studiu clinic care include pacienți reprezentativi pentru majoritatea cazurilor din practica medicală. Coroborând și datele obținute din studiul FIREFISH, risdiplam ar putea fi o soluție pentru toate tipurile de AMS,” explică dr. Peltz.
Mai bine de 400 de pacienți au primit tratament cu risdiplam în cadrul celor 4 studii clinice, fără a semnala până acum efecte secundare grave. Cele mai comune reacții adverse au fost: infecție de tract respirator (31,7%), faringită (25,8%), febră (20,8%), cefalee (20%), diaree (16,7%) și vărsături (14,2%). Niciunul dintre efectele adverse nu au condus la retragerea din cadrul studiului a participanților.
Dr. Levi Garraway, CMO (Chief Medical Officer) și director al departamentului de dezvoltare în cadrul Genentech (Roche Group), a declarat că administrarea orală este o caracteristică esențială pentru risdiplam. Faptul că are un profil de siguranță favorabil și se poate administra ușor poate crește considerabil calitatea vieții pentru pacienții cu AMS, mai ales în contextul în care majoritatea dintre aceștia nu au în momentul de față un tratament, explică Dr. Garraway.
Cum acționează risdiplam?
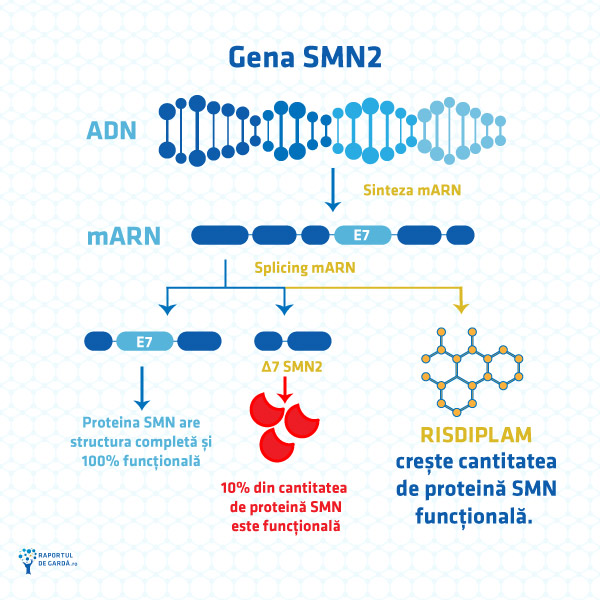
Din punct de vedere biochimic, risdiplam este un derivat de piridazină, un compus heterociclic, izomer al pirimidinei. În acizii nucleici (ADN sau ARN) sunt 3 baze azotate derivate din pirimidină, astfel încât, prin structura sa, risdiplamul poate modifica gradul de exprimare a unei gene. În atrofia musculară spinală, deficitul de proteină SMN cauzat de anomaliile genei SMN1 poate fi compensat de sinteza crescută de proteină SMN prin exprimarea genei SMN2. Cu toate acestea, ADN-ul corespunzător genei SMN2 poate suferi modificări în procesul de transcripție către ARN mesager (mARN).
O genă unică poate sta la baza unor proteine diferite, în funcție de includerea sau excluderea anumitor exoni atunci când se formează ARN-ul mesager. Acest mecanism poartă numele de splicing alternativ. Astfel, o singură genă are potențialul de a codifica mai multe proteine, cu funcții biologice diferite. În cazul proteinei SMN, pentru a ajunge la o formă completă și funcțională, este necesar ca exonul 7 să fie transcris în forma finală a ARN-ului mesager. Dacă acest lucru nu se întâmplă, forma finală a proteinei SMN va fi incompletă și funcțională doar în proporție de 10%. Risdiplam modifică procesul de splicing alternativ al ARN-ului mesager pentru SMN2 și crește cantitatea de proteină SMN sintetizată la nivel celular.
Care sunt opțiunile terapeutice pentru atrofia musculară spinală?
La momentul actual, atrofia musculară spinală beneficiază de 3 opțiuni terapeutice, aprobate de FDA.
- În 2016 a fost introdus în S.U.A. Spinraza (nusinersen), prima terapie modificatoare de boală indicată în AMS tipurile I-III. La fel ca și risdiplam, nusinersen acționează prin reglarea expresiei ARN-ului mesager pentru pentru gena SMN2. Diferența majoră constă în modul de administrare. Tratamentul cu Spinraza presupune injecții administrate intratecal (în lichidul cefalorahidian care înconjoară măduva spinării) pentru tot restul vieții pacienților;
- Zolgensma a fost aprobată de FDA în 2019 și este indicată la pacienții cu vârste sub 2 ani cu atrofie musculară spinală, având mutație bialelică la nivelul genei SMN1. Zolgensma este administrat o singură dată, intravenos și acționează prin introducerea genei SMN1 funcționale în corp. Astfel, proteina SMN va fi sintetizată corespunzător;
- Risdiplam, singura terapie cu administrare orală, indicată în tipurile I-III de AMS, aprobată de FDA în 2020.
Zolgensma este a 2-a terapie genică aprobată de FDA, după Luxturna. În 2019, Zolgensma a fost considerată inovația anului, conform clasamentului realizat de cititorii Raportuldegarda.ro. Despre progresul terapiilor genice și procesul de implementare al acestora, puteți afla mai multe aici:
Citește și:
- Zolgensma, prima terapie genică pentru atrofia musculară spinală, primește aprobare condiționată în UE
- FDA aprobă viltolarsen, a doua terapie țintită pentru pacienții cu distrofie musculară Duchenne, care acționează prin exon 53 skipping
- Știința întâlnește Politicienii 2020: Implementarea inovației în Strategia Națională de Sănătate 2021-2027

