FDA aprobă pralsetinib, a doua terapie țintită pentru cancerul pulmonar non-microcelular cu mutații RET
Pralsetinib (denumire comercială Gavreto, produs de Blueprint Medicines) este aprobat de către Administrația Medicamentelor și Alimentelor (FDA), în SUA, pentru tratamentul adulților diagnosticați cu cancer pulmonar non-microcelular (NSCLC), care prezintă mutații în gena RET, de tip fuziune. Pentru a confirma acest diagnostic și indicația terapiei cu pralsetinib, FDA a aprobat și un test genetic companion, Oncomine Dx Target (ODxT) Test (produs de Life Technologies).

Aceasta este a doua terapie țintită cu indicație în NSCLC RET-pozitiv, după aprobarea selpercatinib, în mai 2020. Terapiile țintite reprezintă o opțiune terapeutică deosebit de importantă în tumorile cu o mutație promotoare identificată, după cum a afirmat și Dr. Vivek Subbiah, director medical al Centrului de Terapii Țintite din cadrul Centrului de Oncologie MD Anderson, din Houston, Texas și cercetător implicat în studierea pralsetinib:
„Terapiile țintite au ameliorat în mod semnificativ îngrijirea pacienților cu cancer pulmonar non-microcelular, în cazurile în care este identificată oncogena cauzatoare (de exemplu, EGFR sau ALK). Aprobarea pralsetinib, un inhibitor selectiv RET, reprezintă un nou pas către adoptarea medicinei de precizie în oncologie.”
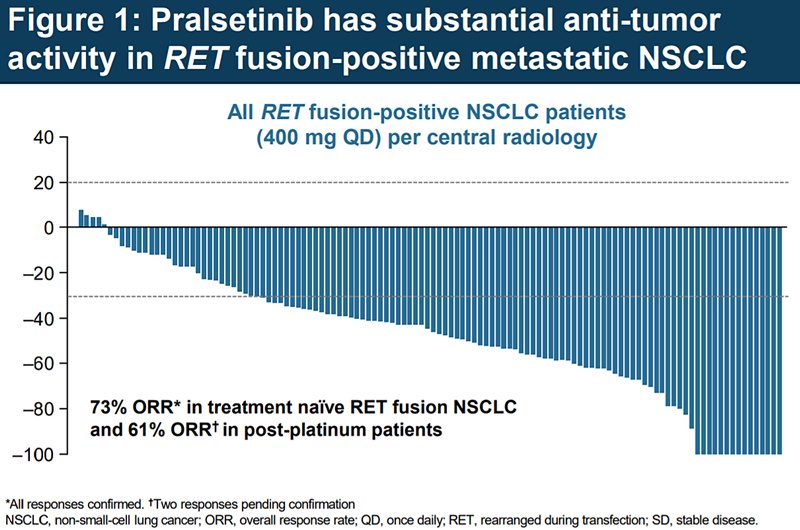
Aprobarea pralsetinib se bazează pe rezultatele pozitive din studiul ARROW, un studiu de fază 1/2, cu metodologie de tip open label, care a inclus pacienți cu diferite tipuri tumorale RET-pozitive (cancer tiroidian medular, pulmonar non-microcelular, sau alte tipuri histologice la care s-a identificat mutația RET). În total, studiul a inclus 87 de pacienți cu NSCLC, care aveau în antecedente tratament chimioterapic pe bază de compuși de platină și 27 de pacienți fără tratamente pentru NSCLC în antecedente. Rezultatele au fost următoarele:
- Rata globală de răspuns la pacienții pretratați a fost de 57%;
- Răspunsul a durat peste 6 luni la 80% dintre aceștia;
- 5,7% dintre pacienți au prezentat răspuns complet;
- 70% dintre pacienții care nu au mai fost tratați anterior au răspuns la pralsetinib;
- Rata de răspuns complet la tratament a fost de 11%
- 58% dintre aceștia au avut o durată a răspunsului terapeutic de 6 luni sau mai mult.
Profilul de siguranță al pralsetinib este bun, majoritatea reacțiilor adverse raportate fiind ușoare (grad 1-2). Cele mai frecvente reacții adverse au fost creșterea transaminazelor, scăderea hemoglobinei sanguine, a numărului de limfocite sau neutrofile, creștere creatininei și a fosfatazei alcaline. De asemenea, s-au raportat fatigabilitate, constipație, hipotensiune arterială și dureri musculoscheletice.
Pralsetinib a fost aprobat în mod accelerat, pe baza acestor rezultate preliminarii promițătoare și datorită nevoii mari de inovație terapeutică în acest subgrup oncologic. Studiul ARROW se va continua cu studiul AcceleRET Lung, un studiu de fază III, randomizat, internațional, care își propune recrutarea a 250 de pacienți și care va compara pralsetinib cu chimioterapia pe bază de compuși de platină, în prima linie de tratament pentru cancerul pulmonar non-microcelular, metastatic, RET-pozitiv.
Mutațiile genei RET – diagnosticul și tratamentul acestora
Mutațiile RET (Rearranged during transfection) sunt identificate drept cauză în mai multe tipuri de cancer, inclusiv în 1–2% din cazurile de cancer pulmonar non-microcelular. Formele de NSCLC RET-pozitive au un răspuns slab la imunoterapie, însă inhibiția selectivă a RET ar putea aduce beneficii superioare tratamentului chimioterapic.
RET este o genă situată la nivelul cromozomului 10, iar în patologia umană funcționează ca o proto-oncogenă (o genă cu funcție normală, care poate conduce la apariția cancerului în cazul unei activități excesive). RET codifică o proteină de tip tirozin kinază, care acționează drept receptor pentru factori de creștere neurotrofici gliali (GDNF) și este implicată în tumori tiroidiene, endocrine și pulmonare. Mutațiile de tip fuziune sunt cauzate de translocații cromozomiale, care conduc la fuziunea genei RET cu alte gene, astfel producând activarea excesivă a tirozin kinazei și semnalizarea excesivă de supraviețuire, dezvoltare și multiplicare a celulelor tumorale care exprimă această mutație.
Mutațiile RET pot fi detectate prin mai multe tipuri de teste, care includ FISH (Fluorescence in situ hybridization) și NGS (Next Generation Sequencing). Testul companion aprobat, Oncomine Dx Target, este un test diagnostic de tip NGS, capabil să detecteze o gamă largă de mutații care pot fi țintite prin terapii inovatoare (EGFR, BRAF, KRAS, MET, ALK, ROS1, RET, NTRK).
Pralsetinib acționează prin inhibiția selectivă a tirozin kinazelor a căror activitate este accelerată de mutația genei RET. În Uniunea Europeană, a fost înaintată aplicația de punere pe piață a pralsetinib, iar acesta se află în proces de evaluare în cadrul Agenției Europene a Medicamentului (EMA). Primul inhibitor specific RET aprobat la nivel mondial este selpercatinib, aprobat anul acesta de către FDA.
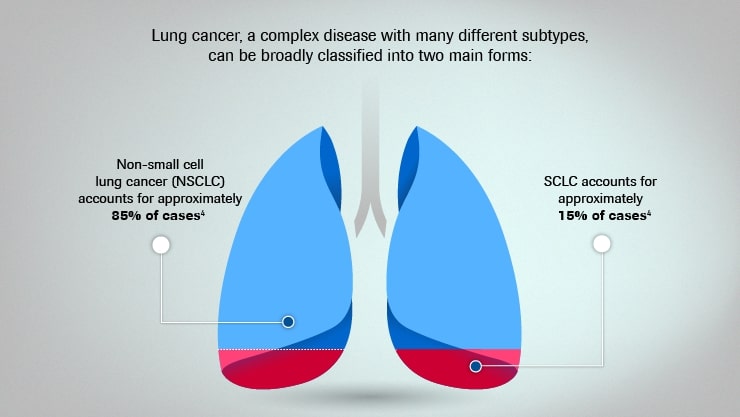
Cancerul pulmonar este cea mai frecventă formă de cancer și principala cauză de mortalitate prin cancer la nivel mondial. Tipul non-microcelular reprezintă 85% din totalul cazurilor. În ciuda faptului că este în mare măsură prevenibilă, 1 din 5 decese cauzate de cancer în Europa se datorează cancerului pulmonar. În țările occidentale, rata de supraviețuire la cinci ani pentru cancerul pulmonar este în medie de 15%. În România, rata de supraviețuire la cinci ani între 2010-2014 a fost de 11,2%.
Citește și:
- LANSARE. Raport The Economist: analiza politicilor pentru cancer pulmonar în 27 de țări. Ce recomandă experții?
- Cancerul pulmonar: prioritate pentru sistemul de sănătate. Cum poate fi scurtat traseul pacientului și care este rolul echipelor multidisciplinare?
- Cancerul pulmonar: prioritate pentru sistemul de sănătate. Strategii pentru depistarea bolii în stadii curabile și rolul diagnosticului de precizie

