Anul 2023 din perspectiva accesului pacienţilor la terapii inovatoare în Uniunea Europeană. Care sunt medicamentele aprobate în al treilea trimestru de EMA
La finalul anului 2023, raportuldegarda.ro vă prezintă principalele progrese înregistrate în domeniul medicamentelor în Uniunea Europeană (UE) în ultimele 12 luni, cele mai inovatoare terapii care au devenit disponibile sau au primit aviz pozitiv pentru aprobare în UE, precum și rezultatele studiilor care au constituit baza autorizării pentru comercializare.
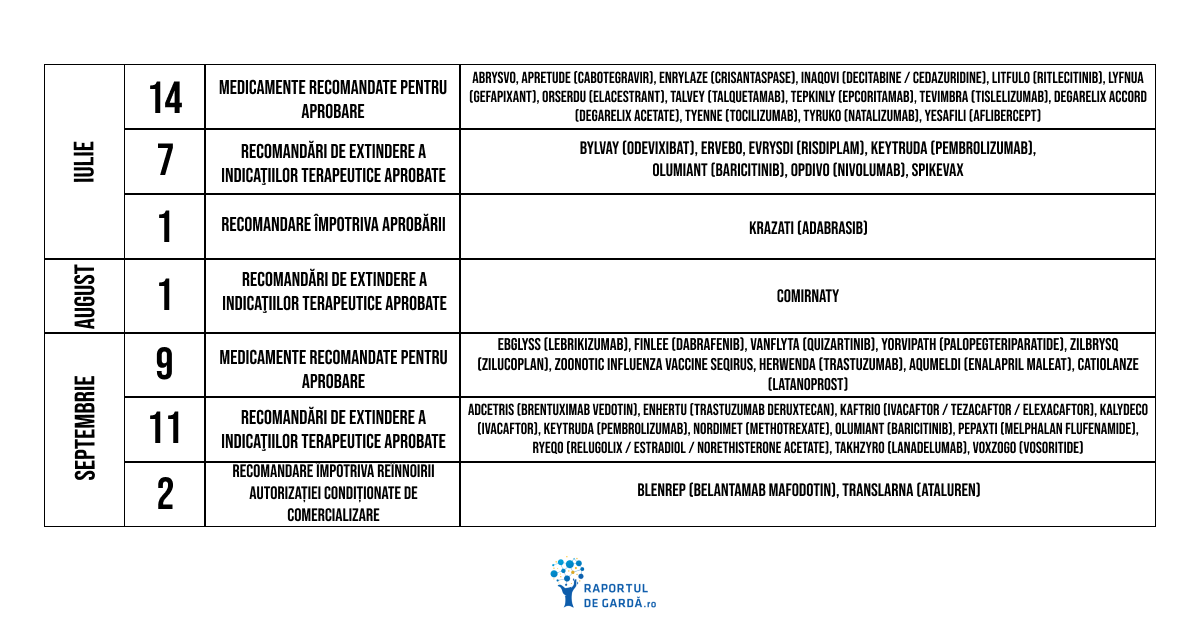
Cele mai importante realizări din al treilea trimestru al anului 2023:
- primul anticorp bispecific care țintește GPRC5D a fost aprobat în august de către Comisia Europeană pentru monoterapia adulților cu mielom multiplu refractar sau recidivat
- primul inhibitor care se atașează ireversibil de FGFR2 a fost autorizat pentru tratamentul pacienților cu colangiocarcinom din Uniunea Europeană
- a fost aprobat în Uniunea Europeană primul vaccin care protejează bebelușii în primele 180 de zile după naștere de bolile asociate virusului respirator sincițial, în urma imunizării active a mamei în cursul sarcinii
Luna iulie 2023 a adus vești bune pentru pacienții cu cancere refractare
Un nou tip de anticorp bispecific a fost aprobat pentru a fi comercializat în Uniunea Europeană în luna iulie. Columvi (glofitamab) este indicat tratamentului adulților cu limfom difuz cu celulă B mare (DLBCL) refractar sau recidivat, după două sau mai multe linii de terapie sistemică.
Dintre pacienții incluși în studiul de fază I/II care a stat la baza obținerii autorizării condiționate de comercializare, peste 80% au fost refractari la cea mai recentă terapie administrată, 90% au fost refractari la o linie de terapie utilizată anterior, iar peste 35% au primit terapie de tip CAR-T. Administrarea Columvi a avut următoarele rezultate:
- peste 35% dintre pacienți au răspuns complet, iar 50% au răspuns complet sau parțial
- aproape 75% dintre persoanele la care s-a obținut răspunsul complet au continuat să fie responsivi la terapie după 12 luni
Columvi este un anticorp bispecific, care prezintă o regiune care țintește CD3 de pe suprafața limfocitului T și 2 regiuni care interacționează cu CD20, marker pentru limfocitul B. Limfocitul B țintit poate fi atât normal, cât și malign. Noul anticorp aduce în apropiere limfocitul de tip T și cel de tip B, declanșând distrucția celulelor maligne de către limfocitul T. Acesta este primul anticorpi bispecific CD20xCD3 care activează limfocitul T aprobat în Europa pentru tratamentul DLBCL.
Comisia Europeană a aprobat Lytgobi (futinatinib) ca monoterapie pentru adulții cu colangiocarcinom local avansat sau metastatic, pozitiv pentru fuziunile sau rearanjamentele genei FGFR2 (fibroblast growth factor receptor 2), a căror boală a progresat după minim o linie anterioară de terapie sistemică. Acesta este primul inhibitor care se atașează ireversibil de FGFR2 autorizat în Uniunea Europeană pentru tratamentul pacienților cu colangiocarcinom.
La baza autorizării se află studiul FOENIX-CCA2, ale cărui rezultate au indicat că administrarea Lytgobi a determinat o rată de răspuns obiectiv de peste 40% și o durata mediană a răspunsului de aproape 10 luni. Răspunsul la tratamentul cu Lytgobi s-a menținut minim 6 luni la peste 70% dintre participanții la studiu.
De asemenea, în luna iulie, în cadrul întâlnirii CHMP, au fost recomandate pentru aprobare următoarele noi medicamente: Abrysvo, Apretude (cabotegravir), Enrylaze (crisantaspase), Inaqovi (decitabine / cedazuridine), Litfulo (ritlecitinib), Lyfnua (gefapixant), Orserdu (elacestrant), Talvey (talquetamab), Tepkinly (epcoritamab), Tevimbra (tislelizumab). Detalii despre întâlnirea lunară CHMP din iulie aici.

Noutățile din august 2023
Talvey (talquetamab), primul anticorp bispecific care țintește GPRC5D, a fost aprobat în august de către Comisia Europeană pentru monoterapia adulților cu mielom multiplu refractar sau recidivat (RRMM), care au primit anterior minim 3 linii de tratament, inclusiv un agent imunomodulator, un inhibitor al proteazomilor și un anticorp anti-CD38, și a căror boală a progresat de la ultima terapie administrată.
După o perioadă de monitorizare de aproape 13 luni, peste 70% dintre participanții la studiu au răspuns la terapia cu Talvey, iar aproape 40% au obținut răspuns de tip complet. Aceste rezultate provin din studiile MonumenTAL-1 (NCT03399799, NCT04634552).
Talvey este un anticorp bispecific, care se atașează de CD3, aflat pe suprafața limfocitelor T, și de GPRC5D, o nouă țintă care are expresie crescută pe suprafața celulelor maligne din mielomul multiplu.
Urmând avizului pozitiv oferit de CHMP în iulie, Comisia Europeană a aprobat Abrysio în august pentru profilaxia afecțiunilor determinate de virusul respirator sincițial (RSV). Abrysio este primul vaccin RSV care poate asigura imunizarea pasivă a bebelușilor, de la naștere, până la vârsta de 6 luni, în urma vaccinării mamei pe parcursul sarcinii. Acest vaccin este, de asemenea, indicat imunizării active a adulților în vârstă de minim 60 de ani.
Două studii clinice au evaluat eficacitatea și siguranța vaccinului Abrysio. În cadrul studiului MATISSE, aproape 3700 de femei gravide au fost imunizate cu noul vaccin în săptămânile 24-36 de sarcină. Vaccinarea a redus atât numărul de cazuri severe de boli ale tractului respirator inferior asistate medical, precum și numărul de astfel de boli care au necesitat asistență medicală în primele 180 de zile după naștere.
Studiul RENOIR a inclus peste 18 000 de adulți în vârstă de minim 60 de ani, care au fost vaccinați cu Abrysio, fiind constatată scăderea cazurilor de boală a tractului respirator inferior asociată RSV cu minim 2 simptome prezente.
De asemenea, CHMP a recomandat aprobarea versiunii adaptate a vaccinului Comirnaty pentru COVID-19 în august, care permite imunizarea împotriva variantei SARS-CoV-2 Omicron XBB.1.5.
Vești bune pentru pacienții oncologici și în luna septembrie 2023
Comisia Europeană a aprobat Orserdu (elacestrant) ca monoterapie pentru femeile aflate la menopauză și bărbații cu cancer de sân local avansat sau metastatic ER+/HER2-, care prezintă mutații activatoare ESR1 și a căror boală a progresat după minim o linie de terapie endocrină, inclusiv un inhibitor CDK 4/6.
Aceasta este prima și singura terapie indicată în mod specific tratamentului tumorilor ER+/HER2- care prezintă mutații ESR1. Mutațiile ESR1 apar în urma administrării terapiei endocrine, fiind prezente la aproape 40% dintre pacienții cu cancer de sân metastatic ER+/HER2-. În cadrul studiului EMERALD, administrarea Orserdu la persoanele cu mutații ESR1 a determinat o supraviețuire mediană în lipsa progresiei bolii dublă față de standardul de îngrijire și a redus riscul de progresie sau deces cu 45%.
Tepkinly (epcoritamab), anticorp bispecific care țintește CD3 și CD20, a fost aprobat pentru a fi comercializat în Uniunea Europeană, fiind indicat pentru monoterapia adulților cu DLBCL refractar sau recidivat, după 1-2 lunii de terapie sistemică. Conform rezultatelor studiului EPCORE NHL-1, aproape 40% dintre pacienții care au primit Tepkinly au răspuns complet la terapie.
Un anticorp monoclonal anti-PD-1, care limitează atașarea de receptorii Fc-gamma de pe macrofage, a fost aprobat de Comisia Europeană pentru monoterapia cancerului esofagian nerezecabil, local avansat sau metastazat, după o linie chimioterapie cu derivați de platină. Eficacitatea Tevimbra (tislelizumab) a fost stabilită în cadrul studiului de fază III RATIONALE 302.

De asemenea, în luna septembrie, în cadrul întâlnirii CHMP, au fost recomandate pentru aprobare următoarele noi medicamente: Ebglyss (lebrikizumab), Finlee (dabrafenib), Vanflyta (quizartinib), Yorvipath (palopegteriparatide), Zilbrysq (zilucoplan), Zoonotic Influenza Vaccine Seqirus. Detalii despre întâlnirea lunară CHMP din septembrie aici.
Despre cum are loc autorizarea medicamentelor în Uniunea Europeană și ce categorii de terapii există poți afla citind primul articol din seria Anul 2023 din perspectiva accesului pacienţilor la inovaţie în medicină în Uniunea Europeană.
Citește și:

