Medicina personalizată în prevenția și depistarea precoce a bolilor: factorii genomici și moleculari trebuie evaluați alături de determinanții sociali ai sănătății pentru estimarea corectă a riscului individual de boală
Fascinația omenirii cu privire la ereditate există dintotdeauna, iar primele însemnări privind studierea genelor datează din 1857, din timpul experimentelor lui Gregor Mendel. La începutul anilor 1900 apare termenul de „genă” pentru descrierea „unităților” eredității, iar în 1953, James Watson și Francis Crick anunță descoperirea bazei fizice a acestor unități prin descrierea structurii ADN-ului. Aceste momente cheie au condus la o nouă etapă a înțelegerii biologiei umane și mecanismelor implicate în patologie. De la descifrarea rolului genelor individuale, am ajuns deja în etapa caracterizării întregului genom pentru determinarea unor scoruri de risc individual din ce în ce mai complexe, pentru a preveni afecțiunile sau trata precoce individul, persoana – recunoscându-i-se mai mult ca niciodată unicitatea.
Medicina de precizie a devenit cunoscută odată cu lansarea Precision Medicine Initiative, în 2015, de către fostul președinte al SUA, Barack Obama. Această abordare presupune schimbarea paradigmei de la medicina axată pe tratarea izolată a bolii – „one size fits all”, în care medicamentul tratează boala și nu pacientul ca întreg – la realitatea actuală, în care atât mecanismele implicate în boală, cât și organismul, sunt înțelese la nivel molecular pentru fiecare pacient și cetățean. Medicina personalizată, deși adesea utilizată ca sinonim pentru medicina de precizie, adaugă încă un nivel de complexitate – integrează toate datele disponibile despre pacient, în contextul clinic și social în care se dezvoltă acesta. În oncologie, de exemplu, avansul științific a fost mai pronunțat decât în alte domenii, astfel că beneficiază de terapii personalizate la cel mai înalt grad posibil până acum.
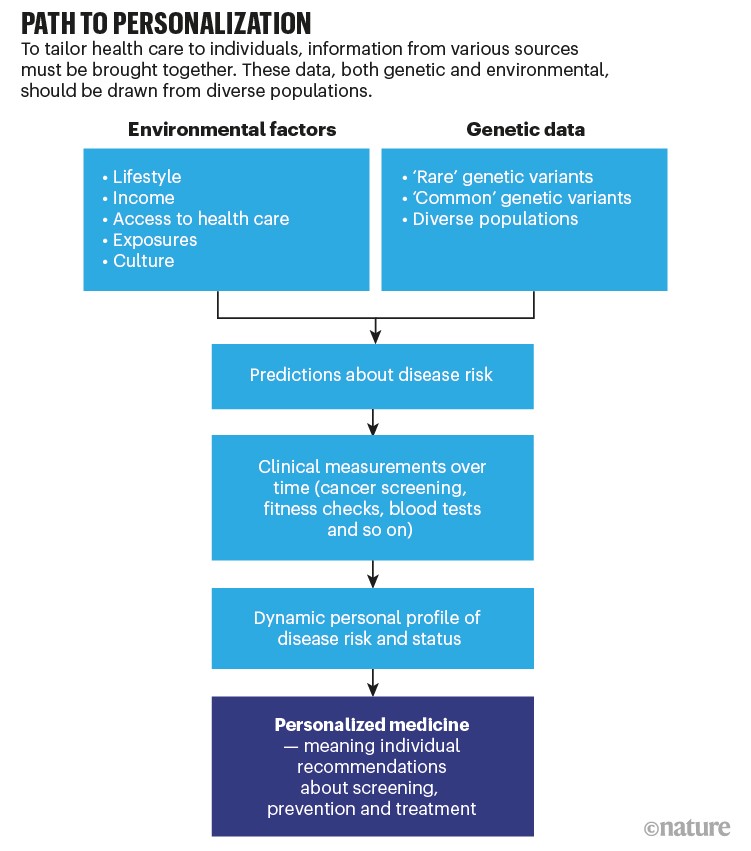
Deși utilizarea scorurilor de risc poligenic pentru determinarea riscului de boală este relativ nouă sau chiar neadoptată în anumite patologii, numeroase studii susțin ideea că pentru a oferi îngrijire cu adevărat individualizată și a preveni bolile în mod personalizat, trebuie ca abordarea să treacă dincolo de genetică și genomică, incluzând valori care urmăresc mediul în care se dezvoltă un om și evoluția sănătății în timp.
Un studiu recent demonstra că impactul factorilor genetici asupra apariției bolilor scade odată cu înaintarea în vârstă și alte mecanisme iau locul ca importanță, inclusiv cele influențate de mediul în care trăiește persoana. Cercetările cu privire la rolul factorilor determinanți ai sănătății sunt în plină desfășurare.
Scopul imediat al implementării scorurilor de risc poligenic în practică este de a avea răspunsuri personalizate atunci când oamenii trebuie să știe dacă, de exemplu, este necesară o intervenție chirurgicală preventivă, este posibil ca un anumit medicament să dea reacții adverse după administrare sau dacă vor trebui să urmeze o anumită dietă pentru întreaga viață din cauza unei afecțiuni. Informațiile privind riscul genetic reprezintă o abordare promițătoare pentru furnizarea acestor răspunsuri. Datele genomice, colectate de la milioane de indivizi, au dezvăluit noi mecanisme asociate cu boli frecvente în populație, cum ar fi diabetul, bolile cardiovasculare, schizofrenia și cancerul

Determinanții stării de sănătate
În medie, 36% din sănătatea unei persoane este influențată de comportamentul individual, 24% de circumstanțele sociale, 7% de mediul înconjurător, și doar 11% de îngrijirile medicale, respectiv 22% de biologie și genetică. Deși accesul la sănătate înseamnă pentru majoritatea oamenilor acces la servicii medicale de calitate, dovezile științifice demonstrează că serviciile medicale, așa cum sunt ele la momentul actual, cu focus pe tratament, sunt doar o parte a problemei. De exemplu, Regatul Unit al Marii Britanii a început demersurile pentru recunoașterea Social Prescribing ca instrument de bază pentru sănătatea publică.
De aceea, o abordare personalizată în determinarea riscurilor individuale de a dezvolta boli, și, mai departe, în a depista precoce acele boli, trebuie să țină seamă atât de componenta genetică, cât și de cea ambientală (care se referă la condițiile de dezvoltare ale individului), integrând date genetice, clinice și care țin de stilul de viață și mediul de dezvoltare al unei persoane. Recent, un studiu a demonstrat că valoarea predictivă a algoritmilor AI pentru determinarea riscului de a dezvolta boli cardiovasculare utilizând date fiziologice și de laborator (ca valorile tensiunii arteriale și colesterolului) este mult mai mare dacă se adaugă date despre determinanții sociali ai stării de sănătate.
Un articol publicat în Nature de către Mark McCarthy și Ewan Birney oferă o argumentare detaliată asupra nevoii de integrare a tuturor determinanților stării de sănătate în scorurile de risc poligenic și identifică principalele îmbunătățiri de realizat.
1. Datele limitate
Deși scorurile de risc poligenic ar putea avea un impact semnificativ în practica clinică, ele nu sunt calculate ținând seamă de toate datele disponibile despre un pacient sau individ. Mai mult, conform autorilor, studiile genomice globale au fost efectuate preponderent pe populația albă, din țări cu un nivel ridicat de trai, ceea ce accentuează inegalitatea în îngrijirea medicală la nivel internațional.
Pentru a obține o evaluare de precizie a riscurilor individuale, cercetătorii și clinicienii trebuie să integreze tipuri diferite de date, reprezentative pentru populații diverse.
De asemenea, „tendința de a împărți diversele profiluri individuale în categorii clinice rigide trebuie să înceteze”. În loc să încadreze e o persoană ca fiind pur și simplu la un risc mediu sau ridicat pentru o afecțiune – de ex. boală coronariană, medicii ar trebui să ia în considerare o gradare a riscului. Concret, în oncologie, tumorile încep să nu mai fie clasificate în funcție de localizare și apar tot mai multe tratamente tumor-agnostic, care țin seamă de caracteristicile genetice tumorale.
2. „Inclusive genetics”
Scorurile poligenice pentru bolile cu debut tardiv sunt în mare parte bazate pe variante de risc comune care au fost descoperite în studii genetice la scară largă. Spre deosebire de variantele genetice rare, cu impact ridicat, care stau la baza unor boli precum fibroza chistică sau anemia falciformă, acestea au, în general, efecte minime, care limitează valoarea lor clinică atunci când sunt considerate pe rând. Însă dacă se combină informații din sute sau mii de variante relevante pentru riscul de boală, poate fi surprinsă o parte substanțială a variației individuale a riscului de a dezvolta acea afecțiune.
Scorurile de risc poligenice au potențialul de a informa deciziile individuale despre screening, intervenții asupra stilului de viață și alegeri terapeutice. De exemplu, în loc ca toate femeile de 45 de ani să fie incluse în screening mamografic anual (așa cum recomandă în prezent ghidurile), pe baza scorurilor poligenice pentru riscul de cancer mamar să fie adaptate programele, astfel încât femeile cu cel mai mare risc genetic să fie examinate mai devreme decât sunt cele cu risc sub nivelul mediu.
O altă preocupare a specialiștilor este că variantele genetice comune spun doar o parte din povestea riscului genetic. În cazul mai multor boli sunt implicate și variantele rare, având adesea un impact mult mai mare asupra riscului decât orice variantă comună. Exemple notabile includ efectele variantelor rare în genele BRCA1 și BRCA2 asupra riscului de cancer mamar și ovarian și a celor din LDLR, APOB și PCSK9 asupra bolii coronariene (mediată prin efectele acestor variante asupra nivelului lipidic).

3. Abordarea holistică
Pentru cele mai frecvente boli cu debut tardiv, riscul individual este puternic influențat de factori non-genetici – denumiți în general factori de mediu sau stil de viață, precum dieta, starea socio-economică, accesul la îngrijiri sanitare, starea relațiilor personale sau diversitatea microbiomului intestinal.
Integrarea acestor factori în estimările de risc este la fel de complexă ca și măsurarea lor într-un mod cât mai obiectiv. Chiar și pentru factori bine înțeleși, cum ar fi fumatul, dieta și exercițiile fizice, impactul pe tot parcursul vieții asupra riscului de boală nu poate fi ușor interpretat utilizând măsurători „instantanee”, cum ar fi pașii parcurși sau caloriile consumate în ultima săptămână.
Factorii ambientali, cum ar fi accesul la asistență medicală, educație, salubrizare eficientă sau locuințe, au un impact profund asupra modelelor individuale de boală. Ca și în cazul riscului genetic, datele colectate de la populațiile mai bogate se pot traduce într-o predicție a bolilor slabă în comunitățile defavorizate.
Factorii de risc genetici și non-genetici interacționează adesea în moduri care pot fi greu de descifrat. De exemplu, variantele genetice care modifică funcția receptorilor de nicotină influențează comportamentul fumatului și, în consecință, sunt asociate cu riscul individual de a dezvolta boli legate de fumat. Și exemplele pot continua – recent, un studiu a demonstrat existența unor modificări genetice care determină tulburări de comportament.
Măsurătorile clinice, în special atunci când sunt colectate constant în timp, reprezintă o altă cale pentru îmbunătățirea estimării riscului. În general, datele clinice colectate în mod repetat de-a lungul timpului – din surse precum teste de sânge, imagistică și dispozitive purtabile (wearables) – dezvăluie modul în care predicțiile derivate din factorii de risc genetici și non-genetici funcționează de fapt la un anumit individ și fac posibilă trasarea unor traiectorii personalizate de la sănătate la boală. Însă aceste date trebuie să fie colectate, stocate și analizate constant și împreună.
4. Menținerea raportării la complexitatea organismului uman
Medicina s-a concentrat istoric pe categorisirea bolilor. Medicina de precizie a urmat adesea aceeași cale, subdivizând oamenii în subtipuri de boală sau stabilind diviziuni arbitrare în funcție de anumite măsurători. Astfel de încadrări presupun că manifestările extrem de variabile ale bolii pot fi explicate cel mai bine prin alocarea indivizilor în grupuri distincte și că fiecare subtip de boală are propriul set de cauze clar definite. Adevărul demonstrat științific este însă cu totul altul, deși există tendința istorică de a simplifica lucrurile în practica medicală. Chiar dacă luarea deciziilor clinice necesită adesea decizii binare (cum ar fi tratarea sau nu într-un anumit moment), este posibil ca acestea să nu fie corelate cu categoriile de boală definite cu ani în urmă.
Cele mai frecvente boli reprezintă o combinație de procese dezordonate, dintre care mai multe sunt particulare unui individului. De exemplu, boala coronariană prematură apare de obicei pe fondul unui amestec de procese anormale, inclusiv metabolizarea anormală al glucozei, creșterea nivelului lipidelor, hipertensiunea arterială și inflamația cronică. Combinația precisă de factori va diferi de la o persoană la alta, variind chiar de-a lungul vieții aceleiași persoane. Doar la relativ puțini indivizi (de exemplu, cei cu hipercolesterolemie familială) boala prematură poate fi atribuită unei singure cauze de natură genetică.
5. Avansul continuu – științific, medical, clinic și la nivel de societate
Tabloul complex prezentat ne duce la întrebarea dificilă: cum poate fi reflectată această complexitate în predicția bolilor? Conform autorilor, eforturile de a baza medicina personalizată numai pe predicția factorilor de risc nu vor avea succes. Toți cei implicați în acest demers – cercetători, industrie, finanțatori, guverne și cetățeni – vor trebui să se colaboreze pentru a permite colectarea unor seturi mari și bogate de date, care depășesc măsurătorile statice unice și care surprind traiectorii individuale ale stării de sănătate.
Citește și:
- STUDIU. Cauzele bolilor rare ar putea fi identificate de 3 ori mai rapid prin analiza datelor multiomice și rețelelor moleculare complexe
- STUDIU. Noi subtipuri ale mielomului multiplu, identificate prin analiză multiomică. Rezultatele ar putea schimba sistemele internaționale de clasificare
- Single-cell functional precision medicine: testarea efectului terapiilor oncologice asupra celulelor tumorale individuale, ex vivo, crește supraviețuirea pacienților cu cancere hematologice agresive

