#AACR24. Ce modificări apar în fazele incipiente ale cancerului și cum pot fi țintite terapeutic? Noutăți de la Congresul American dedicat Cercetării în Oncologie
Noţiunea de cancer nu semnifică o singură boală, ci un grup vast de afecţiuni, caracterizate de proliferarea unor celule care nu mai răspund la sistemele normale de control și reglare a diviziunii celulare.
Cancerul poate să se dezvolte, teoretic, din orice tip celular şi să apară la nivelul oricăror organe din corpul uman. Formaţiunea tumorală formată poate să se asemene relativ bine din punct de vedere histologic cu ţesutul de origine sau poate să prezinte modificări atât de pronunţate, încât să nu existe niciun indiciu cu privire la provenienţa sa.
Celulele normale se transformă în celule maligne printr-o serie de etape, acest proces fiind favorizat atât de substratul genetic, cât şi de o serie de factori de mediu. Carcinogeneza are loc adesea prin acumularea de mutaţii ale genelor implicate în reglarea ciclului celular, repararea ADN-ului şi moartea celulară.
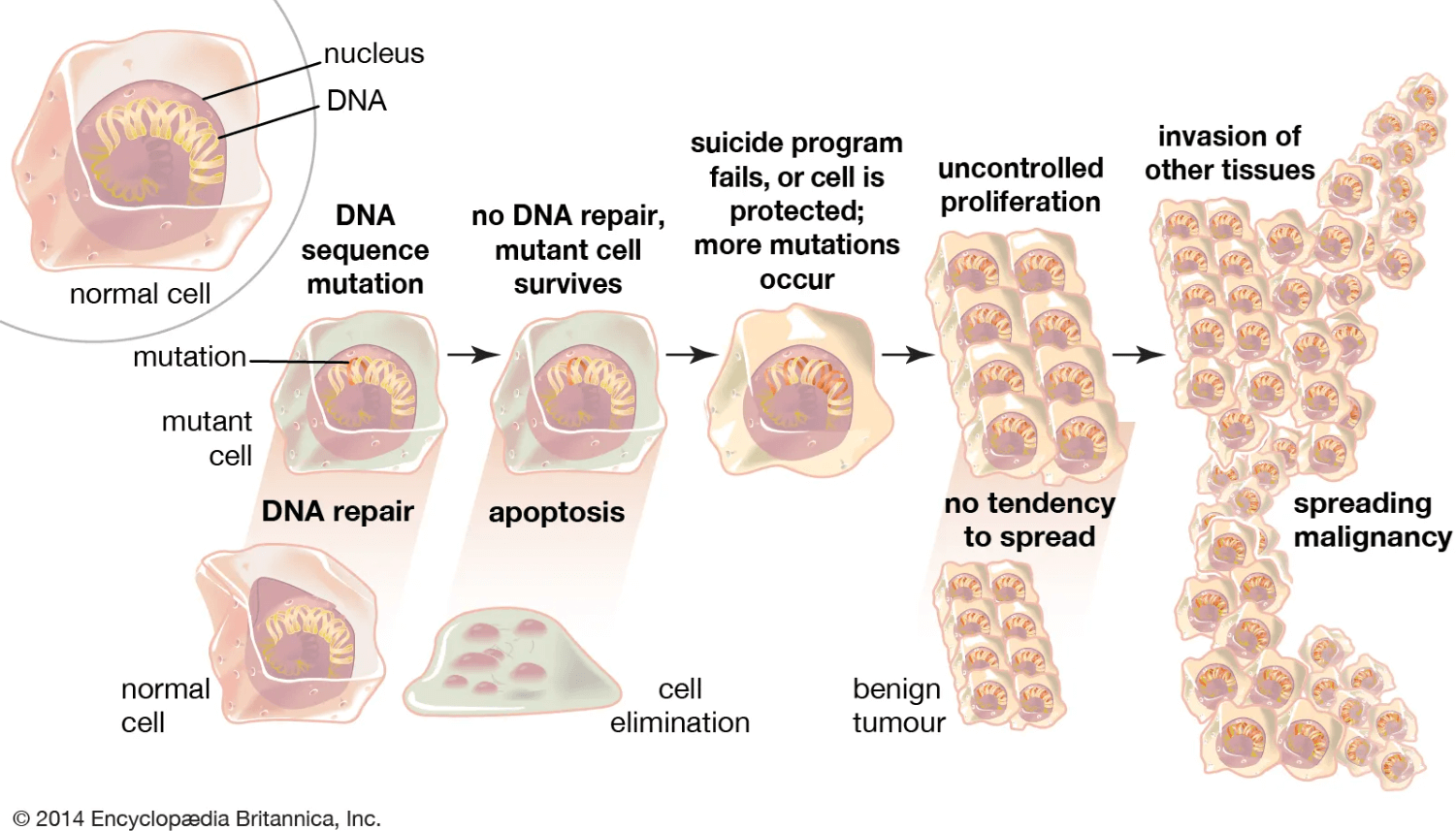
Tipurile de modificări moleculare prezente în celulele maligne sunt complexe şi pot implica genomul, epigenomul, transcriptomul, proteomul, metabolomul etc. Acestea favorizează proliferarea proliferarea necontrolată, supravieţuirea celulară, dar şi instabilitatea genomică. Odată dezvoltate, tumorile maligne, spre deosebire de cele benigne, sunt în general capabile de invazie, atât locoregională, cât şi la distanţă, formând metastaze, iar în lipsa tratamentului conduc la decesul pacientului.
Celula malignă – cât de multe ştim despre aceasta?
Întrucât în 2000 literatura științifică despre cancer era deja bogată și complexă, a fost necesară revizuirea acesteia și identificarea acelor caracteristici esențiale ale neoplaziilor. Din aceste motive, în 2000, a fost inițiată o serie de lucrări științifice despre biologia afecțiunilor maligne, numită ”Hallmarks of cancer”, când doi cercetători a căror cariera s-a concentrat pe înțelegerea cancerului, Robert Weinberg și Douglas Hanahan, au publicat un review în Cell despre caracteristicile neoplaziilor.
Articolul și-a propus să organizeze cunoștințele despre cancer într-un cadrul logic, surprinzând complexitatea afecțiunii și definind trăsăturile fundamentale care sunt prezente la majoritatea tumorilor maligne umane. Acest review a devenit o resursă esențială pentru a înțelege biologia cancerului. Astfel, au fost definite în primul articol din seria ”Hallmarks of cancer” 6 caracteristici de bază care reflectă procesul etapizat al transformării celulelor normale în celule maligne:
- Autosuficiența legată de semnalele de creștere
- Lipsa de sensibilitate la semnalele de supresie a creșterii
- Abilitatea de a evita moartea celulară programată
- Activarea imortalității replicative
- Angiogeneza susținută
- Invazia tisulară și metastazarea
Acumularea de mutaţii multiple prin pierderea unuia sau mai multor mecanisme care protejează integritatea genomului reprezintă modalitatea prin care celulele dobândesc aceste caracteristici de malignitate, care au fost raportate pentru minim 100 de tipuri de cancer până la momentul publicării articolului.
Cum definesc aceste caracteristici cancerul?
Celulele normale depind de semnalele externe de proliferare, însă cele maligne își generează aceste semnale ele însele. Astfel, dependența de stimulii externi de creștere este mult redusă, până la eliminarea completă. Țesutul malign este complex, iar celulele canceroase cooptează activ alte tipuri celulare pentru a își asigura cele semnalele necesare.
Semnalizarea implicată în supresia creșterii menține homeostazia la nivelul țesuturilor normale, în anumite contexte celulele fiind trimise fie într-o stare de repaus din punct de vedere proliferativ, fie într-o fază terminală, un status de diferențiere post-mitotică. În celulele transformate malign, aceste mecanisme care controlează ciclul celular sunt deturnate.
Celulele maligne devin imortale prin faptul că evita apoptoza, moartea celulară programată, dar și prin activarea imortalității replicative, astfel că acestea se divid pe termen nedefinit. Celulele normale, în schimb, pot prolifera pe o perioadă limitată, urmând ca diviziunile celulare să fie întrerupte la un anumit punct, întrucât cu fiecare diviziune are loc scurtarea fragmentelor repetitive terminale ale ADN-ului, numite telomere. Celulele maligne prezintă telomerază activă, enzimă care menține lungimea telomerelor deasupra pragului care le permite continuarea proliferării.
Deoarece neoplazia aflată în curs de creștere are necesități crescute de oxigen și nutrienți, la nivel tumoral se eliberează semnale pro-angiogenice, rezultând formarea de noi vase de sânge. Astfel, cancerul crește de la leziuni microscopice la stadii macroscopice.
Posibilitatea de a se stabili şi prolifera în ţesuturi la distanţă şi diferite de cel de origine este una dintre caracteristicile principale ale malignităţii. Metastazarea reprezintă una dintre cauzele majore de deces prin cancer.
”Hallmarks of Cancer: The Next Generation”
Următorul articol din serie, publicat în Cell în 2011, a descris progresele din deceniul următor legate de înţelegerea celor 6 caracteristici enumerate în lucrarea din 2020 şi, totodată, a evidențiat două potențiale trăsături adiționale ale celulelor maligne:
- reprogramarea metabolismului energetic
- evitarea distrucţiei imune
În timp ce celulele normale utilizează oxigenul pentru a procesa glucoza şi produce energie, celulele maligne pot să realizeze glicoliză anaerobă chiar şi în prezenţa oxigenului. Deşi acest metabolism este mai puţin eficient, este mai rapid şi generează produşi intermediari care sunt utilizaţi de celulele canceroase drept precursori pentru sinteza de proteine, ADN şi lipide care susţin proliferarea accelerată. Alte celule maligne pot utiliza lactatul ca sursă principală de energie.
Sistemul imun este o barieră esenţială pentru carcinogeneză. Malignizarea are loc mai frecvent şi mai rapid în contextul imunodeficienţelor, în special când este prezentă depleţia limfocitelor T citotoxice sau helper sau a celulelor NK (natural killer). Tumorile umane cu infiltrare imună ridicată au prognostic mai bun.
O altă caracteristică care a fost adusă în lumină de articolul din 2011 a fost prezența inflamaţiei care favorizează procesele tumorale. Anumite celule de tip inflamator pot să elibereze factori de creştere, supravieţuire şi proangiogenici pentru celulele tumorale, dar şi să elibereze compuşi, precum speciile reactive de oxigen, care determină mutaţii adiţionale. Astfel, micromediul tumoral este esenţial şi, odată cu celulele maligne, trebuie studiat şi acesta pentru a înţelege şi dezvolta soluţii terapeutice pentru cancer.
”Hallmarks of Cancer: New Dimensions”
După 10 ani, în articolul publicat în Cancer Discovery, cele două caracteristici dezbătute în articolul din 2011 au fost cuprinse în lista principală de trăsături ale cancerului, deoarece pe parcursul acestei perioade a fost confirmată importanța reprogramării metabolice și evitării distrucției imune pentru neoplazii. Totodată, a fost propusă o nouă potențială caracteristică: plasticitatea fenotipică și perturbarea diferențierii.
Diferențierea terminală în celulele normale este asociată cu întreruperea permanentă a proliferării, însă celulele maligne se sustrag din procesul de diferențiere și deblochează fenomenul de plasticitate fenotipică pentru a continua să crească. Acestea își pot schimba identitatea într-o stare celulară care poate să prolifereze.
Acest lucru se poate întâmpla în diferite moduri: celulele care se apropie de diferențierea completă se pot dediferenția înapoi la o stare asemănătoare progenitorului sau celulele neoplazice care provin dintr-o celulă progenitoare nediferențiată pot opri procesul de diferențiere și rămân în acea stare parțial diferențiată, asemănătoare progenitoarei, iar celulele care au fost angajate într-un anumit fenotip de diferențiere pot schimba programele de dezvoltare sau se pot transdiferenția, dobândind trăsături care nu sunt asociate cu celula lor de origine.
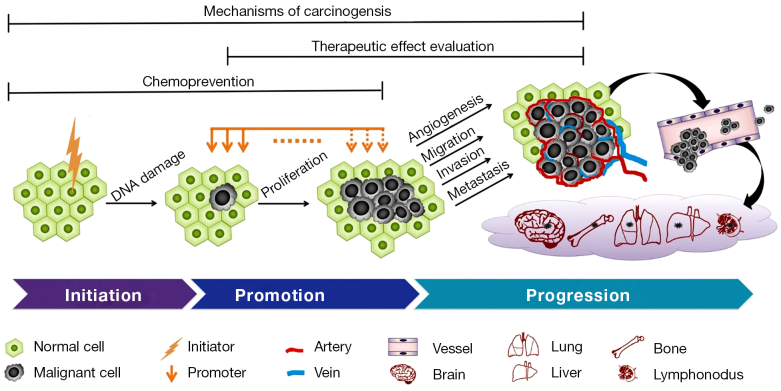
Totodată au fost discutate două trăsături care ar putea fi în viitor incluse în lista de bază: reprogramarea non-mutațională de tip epigenetic și microbiomul. Celulele neoplazice pot reproduce mecanismele care apar în mod normal în cursul embriogenezei și dezvoltării, astfel că au posibilitatea de a reprograma gene sau rețele de reglare a expresiei genice, favorizând achiziția caracteristicilor maligne. De asemenea, anumite microorganisme pot să favorizeze sau să limiteze dezvoltarea și progresia cancerului, dar și răspunsul la tratament.
De asemenea, cea mai recentă ediție ”Hallmarks of cancer” arată că celulele senescente ar trebui să fie incluse ca elemente semnificative ale micromediului tumoral, deoarece în anumite contexte acestea pot să stimuleze dezvoltarea tumorală și progresia neoplaziei.
De la înţelegerea cancerului la strategii de a combate această boală
Aproximativ 70% dintre decesele asociate cancerului sunt cauzate de tipuri tumorale pentru care nu există metode disponibile de screening. Depistarea precoce a cancerului are cel mai mare impact asupra supravieţuirii, în aceste etape probabilitatea de succes a terapiilor fiind cea mai ridicată.
Strategiile de detecție precoce a cancerului depind de înțelegerea modificărilor moleculare și a proceselor care au loc pe măsură ce o celulă evoluează din normala către pre-canceroasă și apoi în malignă. Din aceste motive, în cadrul întâlnirii American Association for Cancer Research de anul acesta, a fost organizată o întreagă sesiune de prezentări dedicată biologiei cancerului precoce.
Au fost expuse modificările care stau la baza hematopoiezei clonale, a fost explicat de ce riscul de cancer mamar crește cu vârsta, şi, de asemenea, au fost detaliate mecanismele prin care instabilitatea genomică promovează carcinogeneza, discutându-se, totodată, despre modalități de a o ținti terapeutic.
Cum apar neoplaziile hematologice?
Modificările precoce din cancerele hematologice au fost prezentate de Margaret Goodell, profesor în cadrul Baylor College of Medicine. Hematopoieza clonală constă în proliferarea unei populații distincte genetic de celule stem hematopoietice. Hematopoieza clonală apare odată cu înaintarea în vârstă, ca și modificare premalignă, și crește riscul de neoplazii hematologice.
Printre mecanismele implicate în hematopoieza clonală se numără apariția mutațiilor la nivelul genei PPM1D, care codifică proteina p53 de tip supresor tumoral WIP1. Aceste mutații inactivează funcția de reparare a ADN-ului și mecanismele implicate în moartea celulară, favorizând proliferarea celulelor la nivelul cărora nu au fost corectate erorile care apar în materialul genetic.
Pacienții care au primit anterior chimioterapie prezintă adesea celule sangvine cu mutații ale PPM1D. Totodată, chimioterapia crește frecvența mutațiilor genei SRCAP, care au drept consecință amplificarea mecanismelor de reparare a ADN-ului. Deși aceste mutații au efecte opuse, ambele oferă avantaje de supraviețuire celulelor stem hematopoietice.
De asemenea, o genă esențială de tip supresor tumoral pentru celulele hematopoietice este DNMT3A. Anumite mutații ale acestei gene cresc capacitatea de auto-regenerare celulară, cel mai probabil prin impact de tip epigenetic. Toate aceste modificări genetice ar putea fi țintite terapeutic pe viitor, atâta timp cât vor fi identificate acele mutații cu efecte negative și modul în care acestea alterează funcțiile celulare.
De ce crește riscul de cancer de sân cu vârsta?
Despre modificările precoce care determină dezvoltarea cancerului de sân a vorbit Kornelia Polyak, profesor în cadrul Harvard Medical School şi Dana-Farber Cancer Institute. Studiul pe animale de laborator a relevat că îmbătrânirea se asociază cu proliferarea dereglată a celulelor epiteliale mamare. Odată cu înaintarea în vârstă s-au constatat următoarele modificări: alterarea expresiei genice, modificarea proporției diferitelor celule imune, stări tisulare alterate și declinul unor variate funcții celulare.
Printre genele a căror expresie a crescut cu înaintarea în vârstă în țesutul mamar de la animalele de laborator este factorul de creștere MDK. Niveluri ridicate ale acestui marker au fost raportate și în probele de plasmă de la persoanele cu cancer de sân.
Majoritatea cancerelor de sân sunt diagnosticate la persoane în vârstă de minim 55 de ani. Persoanele sub 55 de ani care au prezentat niveluri crescute de MDK în țesutul mamar normal au avut risc de 5 ori mai ridicat de cancer de sân în următorii cinci ani. Persoanele tinere cu cancer de sân care au prezentat niveluri crescute de MDK au avut rate mai reduse de supraviețuire în lipsa bolii.
MDK ar putea să contribuie la dezvoltarea cancerului de sân prin activarea căii de semnalizare PI3K, care promovează carcinogeneza. Totodată, ar putea să suprime căile de supresia tumorală și să crească activitatea metabolică, consecințe mediate de SREBF1, care funcționează drept reglator al metabolismului celular.
Cum poate determina infecţia cu virusul Epstein-Barr cancer?
Don Cleveland, profesor în cadrul UC San Diego School of Medicine, a explicat cum contribuie procesul de chromothripsis la dezvoltarea cancerului. Atunci când apar, cromozomii anormali se pot acumula în micronuclei, unde suferă procesul de chromothripsis, sub acțiunea nucleazei N4BP2. Fragmentele cromozomiale rămân apropiate unele de altele cu ajutorul proteinei de reparare a ADN-ului TOPBP1, iar această proximitate facilitează legarea aberantă a fragmentelor de cromozom sub formă de ADN circular, care amplifică expresia anumitor oncogene și conduc la rezistență la medicamente.
Modificări similare ar putea fi determinate de infecția cu virusul Epstein-Barr. Proteina virală EBNA1 se leagă de o secvență de ADN asemănătoare EBV de la nivelul cromozomulului 11, ceea ce duce la ruperea cromozomului și la separarea genei MLL de restul cromozomului 11. Fragmentul de ADN care conține gena MLL intră în micronuclee și are loc procesul de chromothripsis, religarea și amplificarea MLL. Aceasta inactivează proteina de reparare a ADN-ului ATM și astfel poate promova formarea cancerului.
Poate fi țintită terapeutic instabilitatea genomică?
Acumularea de leziuni la nivelul ADN-ului care nu sunt reparate poate să determine moartea celulară, inclusiv la nivelul celulelor maligne. Un inhibitor chimic investigațional, numit XRD-0394, al proteinelor ATM și DNA-PK, care au rol în repararea ADN-ului, ar putea să sensibilizeze celulele la radioterapie. Activitatea acestor proteine nu este esențială pentru supraviețuirea celulară, iar lipsa oricăreia dintre acestea determină sensibilitate la radioterapie.
Esențial este faptul că XRD-0394 determină moartea celulară doar în prezența radioterapiei, astfel că poate fi administrat sistemic, cu limitarea toxicității. Rezultatele studiilor care evaluează XRD-0394 au fost expuse de Dr. Michael Kastan, profesor în cadrul Duke University şi director executiv al Duke Cancer Institute.
De asemenea, a fost inițiat studiul clinic de fază I pentru a evalua siguranța și proprietățile farmacocinetice ale administrării medicamentului la pacienți. Până în prezent nu au fost depistate toxicități limitante de doză, iar inhibarea ATM a avut loc cu succes.

Citeşte şi:
- #AACR24. Saruparib, un nou inhibitor PARP, sigur și eficient la pacientele cu cancer de sân avansat HER2 negativ
- #AACR24. Cancerul de prostată este mai agresiv la anumite grupuri etnice. Biomarkerii proteogenomici indică riscul de recurență și tratamentul țintit
- #AACR24. Mai puțin de 50% din terapiile aprobate pe cale accelerată de FDA demonstrează beneficii clinice după 5 ani

