Raport IHE. Cercetarea în oncologie, o prioritate pentru noua Comisie Europeană: se estimează o creștere a finanțării din surse publice
Cercetarea este fundamentală pentru a realiza îmbunătățiri în ceea ce privește îngrijirea cancerului. În ultimul deceniu, investițiile în dezvoltarea terapiilor și în cercetarea cancerului de către industria farmaceutică au crescut exponențial față de investiții realizate de orice surse publice sau cele non-profit. Datorită noilor puncte de interes ale Comisiei Europene, cercetarea cancerului în Europa ar putea primi mai multă atenție și finanțare și din sursele publice.
Raportul „Comparator Report on Cancer in Europe 2019” realizat de către IHE (The Swedish Institute for Health Economics) prezintă perspectiva cancerului privită în context european. Acesta reprezintă o variantă actualizată a raportului precedent, realizat în perioada 2005-2016.
Diagnosticarea imediată a dus la un prognostic mai rapid și la un răspuns mai eficient la tratament

Progresul în ceea ce privește diagnosticarea cancerului a făcut mai ușor de prezis dacă un pacient este mai responsiv la un anumit tratament. Noile tehnologii pot ajuta la caracterizarea anomaliilor genetice și pot să arate noi obiective/ paliere de tratament. Sunt dezvoltate noi teste care pot evalua markerii relevanți din sânge.
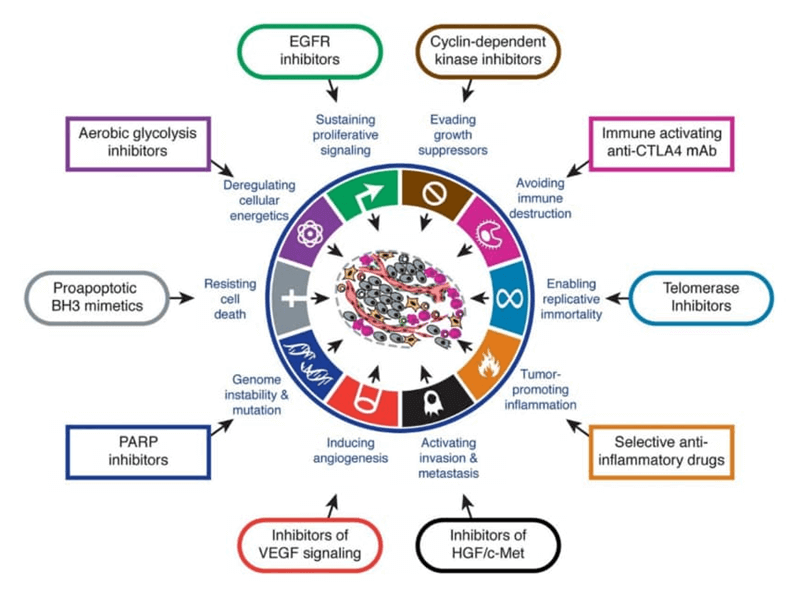
Au fost identificate nenumărate ținte pentru tratamentul cancerului. Peste 40 de molecule sunt utilizate în prezent pentru țintirea protein kinazelor implicate în apariția cancerului. Deși inhibitorii de tirozin kinază nu au avut efectul anticipat, odată cu apariția imatinib, au adus totuși o valoare semnificativă în mai multe situații. Majoritatea acestor medicamente sunt utilizate în stadii tardive, de cancer avansat sau metastatic, care au un prognostic rezervat.
Anticorpii sunt considerați din multe puncte de vedere medicamente ideale pentru cancer. Peste 30 de anticorpi sunt utilizați în prezent în oncologie și hematologie și peste 300 sunt în dezvoltare clinică. Zonele de interes în cercetare, din care ar putea proveni următoarea mare descoperire în tratamentul cancerului, sunt: ADC (Antibody-drug conjugate), anticorpii bispecifici, multispecifici și oligoclonali, nanoanticorpii și anticorpii mimetici.
Creșterea numărului de medicamente aprobate
Cercetările patologiei canceroase au dus la o creștere a numărului de indicații de tratament și a medicamentelor aprobate pentru cancer din ultimii ani. Aproximativ zece medicamente noi au fost aprobate de EMA ( European Medicines Agency) în fiecare an în intervalul 2012-2018, comparativ cu aproximativ patru noi medicamente aprobate anual între 2001 și 2011.
Administrarea tratamentului
A doua tendință în ce privește îngrijirea cancerului este trecerea de la un tratament în regim de internare la un regim de ambulatoriu. Internarea pacienților pentru administrarea tratamentului este mult mai scumpă comparativ cu tratamentul ambulator. Această schimbare este parțial rezultatul unor noi modalități de tratament împotriva cancerului. Administrarea orală a medicamentelor pentru cancer a devenit, de asemenea, mai frecventă și permite administrarea tratamentului la domiciliul pacientului.
Creșterea numărului de terapii studiate
Natura cercetărilor în domeniul cancerului efectuate de companiile farmaceutice a cunoscut, de asemenea, unele schimbări notabile. Din 2013 până în 2018, s-a înregistrat o creștere de 63% a numărului de terapii studiate, 849 de terapii doar în 2018. Terapiile țintite cu molecule mici și tratamente biologice au reprezentat 91% din toate terapiile realizate în 2018.
Tratamentul țintit cu molecule mici
Genomul uman codifică mai mult de 500 de proteine, cu rol de kinaze. Mutațiile, supraexpresiile și dereglarea unora dintre aceste kinaze au fost identificate ca fiind promotori în inițierea și progresia cancerului. În momentul de față sunt 43 de inhibitori de kinaze aprobați și utilizați, atât în oncologie, cât și în hematologie.
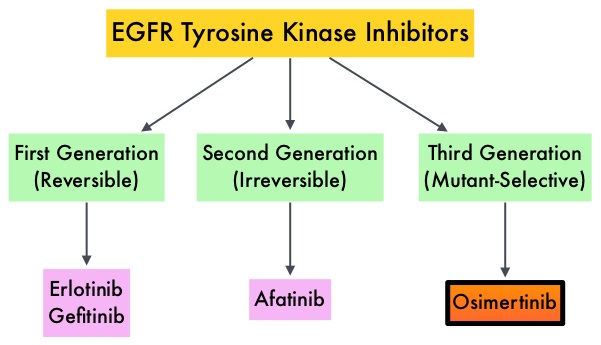
Cu toate că inhibitorii de tirozin kinază (TKI) nu au avut rezultatul anticipat la apariția imatinib, aceștia au numeroase indicații în special în cazuri de cancerul pulmonar, melanom, cancer de vezică, tumori stromale intestinale și anumite cancere hematologice.
Osimertinib a devenit rapid o terapie de primă linie în cazul cancerului pulmonar non-microcelular EGFR+, deoarece este un puternic inhibitor al celor mai frecvente modificări ale EGFR, inclusiv EGFR T790M, cea mai frecventă modificare asociată cu rezistența la inhibitorii anteriori ai EGFR, cum sunt gefitinib și erlotinib.
În ultimii ani au fost aprobate multiple terapii:
- inhibitorii de CDK 4/6, asociați cu terapia hormonală, au demonstrat o eficacitate ridicată în cancerul de sân care prezintă receptori de estrogen (ER+) și sunt în momentul de față terapie de prima linie în cazul multor pacienți cu cancer metastatic;
- Inhibitorii de BRAF (dabrafenib);
- Inhibitorii de MEK (trametinib) au fost aprobați în melanomul cu mutație BRAF+ cu risc mare de evoluție severă;
- Imatinib este aprobat în cazul tumorilor GIST (Tumori stromale gastrointestinale);
- Sunitinib este aprobat pentru pacienții cu cancer renal cu risc crescut (aprobarea este valabilă pentru S.U.A.);
- Combinația axitinib și pembrolizumab pentru cancerul renal a fost recent aprobată datorită datelor rezultate din studiul Keynote-426.
Inhibitorii de tirozin kinază sunt de asemenea testați în combinație cu inhibitorii VEGFR (ramucirumab – Cyramza) în cazul cancerului pulmonar cu mutații EGFR+, combinație superioară monoterapiei cu erlotinib. În plus, combinația gefitinib (inhibitor EGFR) și chimioterapie a arătat rezultate superioare monoterapiei cu gefitinib în cazul cancerului pulmonar.
În anii următori este prognozată aprobarea unor noi ținte terapeutice în forme tumorale care nu beneficiază, în acest moment, de un tratament eficient. Recent au fost prezentați:
- inhibitori RET pentru pacienții cu fuziuni RET;
- inhibitori MET pentru pacienții cu mutații cMET la nivel de exon 14;
- inhibitori EGFR cu eficacitate în cazul inserțiilor la nivel de exon 20 și alți agenți activi în ROS1 G2032R, cele mai comune mutații asociate cu rezistența la inhibitorii ROS1 folosiți în mod curent.
Mai mult, există mai mult de 150 de noi inhibitori de tirozin kinază aflați în studiile clinice și multe alte moleculele sunt în dezvoltare pre-clinică.
Anticorpii bispecifici, multispecifici, conjugați, mimetici și nanoanticorpii – direcțiile de cercetare actuale
Anticorpii constituie o piesă importantă a în mecanismul terapeutic oncologic modern și sunt, în multe privințe, medicamente ideale pentru tratamentul cancerului datorită specificității lor înalte pentru substratul biologic, farmacocineticii favorabile și activitatea multiplă, care depinde de construcția și de modul de legare al epitopului. Anticorpii au fost dezvoltați atât împotriva liganzilor cât și a receptorilor.
În prezent, există peste 30 de anticorpi aprobați în oncologie/hematologie, indicațiile variind de la stadii tardive metastatice, la terapie adjuvantă în forme vindecabile, și de la monoterapie la combinație cu alte terapii. Peste 300 de anticorpi sunt în dezvoltare clinică ce vizează cancerul și mai mult de 30 în studii de faza III.
- Anticorpii de tip ADCs (antibody-drug conjugates)
Acestia sunt anticorpi monoclonali care sunt legați de substanțe chimice citotoxice prin interediul unui ligant sintetic. Principiul este de a permite livrarea extrem de selectivă a unui agent citotoxic către celulele tumorale, care devine activ la nivelul țintei principale. Astfel, crește eficacitatea anti-tumorală, și în același timp scade toxicitatea în restul organismului, care este de obicei semnificativă în cazul terapiilor citotoxice.
Datele raportate recent arată o eficacitate impresionantă atât în cazul cancerului de sân, cât și în cancerul vezical, și sunt așteptate aprobări noi pentru această clasă de medicamente. Sunt deja patru ADCs aprobate:
- trastuzumab emtansine (Kadcyla);
- brentuximab vedotin (Adcetris);
- gemtuzumab ozogamicin (Mylotarg);
- inotuzumab ozogamicin(Besponsa).
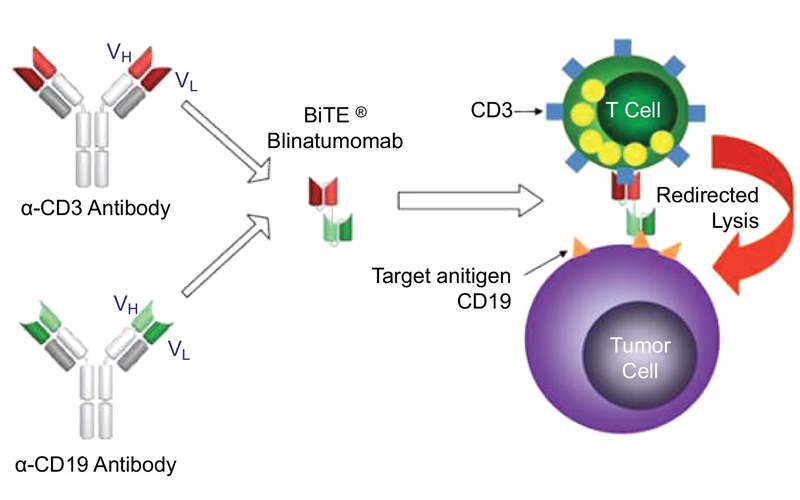
- Anticorpii bispecifici
În prezent, există doi anticorpi bispecifici aprobați în oncologie. Alți aproximativ 50 anticorpii bispecifici sunt în dezvoltare clinică. De asemenea, există în dezvoltare anticorpi multispecifici și oligoclonali. Cei aprobați sunt:
– blinatumomab (utilizat în tratamentul leucemiei acute limfoblastice);
– catumaxomab (utilizat ca tratament intraperitoneal pentru ascita malignă asociată carcinoamului epitelial EpCAM+).
- Nanoanticorpii și anticorpii mimetici
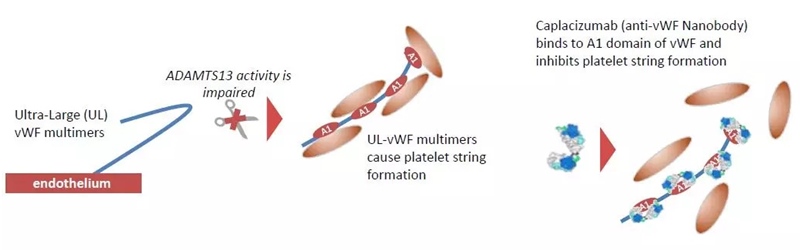
Nanoanticorpii sunt fragmente de anticorpi alcătuite dintr-un singur domeniu monomeric variabil. Similar unui anticorp, aceștia se pot lega selectiv de un antigen specific. Avantajul nanoanticorpilor este că sunt mult mai mici și au o greutate moleculară mai mică (12-15 kDa) față de un anticorp obișnuit (150-160 kDa), iar acest lucru le conferă un acces mult mai facil la nivelul spațiului interstițial. Primul nanoanticorp a fost aprobat în anul 2018 – caplacizumab (folosit pentru purpura trombotica trombocitopenică). Deși nu este utilizat în oncologie, reprezintă un pas important de dezvoltare și relevă noi oportunități de dezvoltare în oncologie.
Imuno-oncologia
În mai puțin de un deceniu, imunoterapia a devenit o piatră de temelie în terapia cancerului. Medicamente precum ipilumumab (inhibitor CTLA-4), pembrolizumab, nivolumab, cemiplimab ( inhibitor PD-1), atezolizumab, durvalumab (inhibitor PD-L1) au fost aprobate pentru utilizarea în multiple tumori maligne solide, cum sunt: melanomul, NSCLC de tip scuamos sau adenocarcinom, cancer urotelial, cancer de cap și gât, cancer renal, cancer colorectal, limfom Hodgkin, limfom mediastinal cu celule B, adenocarcinom gastric, cancer de col uterin, carcinom cutanat de tip scuamos și, cel mai recent, cancer esofagian.
Combinația de inhibitori PD-1 și CTLA-4 s-a dovedit a fi mai eficientă decât oricare dintre agenții în monoterapie, pentru tratamentul în melanom, însă toxicitatea limitează utilizarea în momentul de față.
Terapiile celulare
În prezent, există aprobate două terapii celulare CAR-T care țintesc CD19 – tisagenlecleucel (Kymriah) și axicabtagene ciloleucel (Yescarta), acestea având rezultate spectaculoase în hemato-oncologie. Tisagenlecleucel este, de asemenea, aprobat pentru leucemia limfatică acută (ALL) cu recidive tardive.
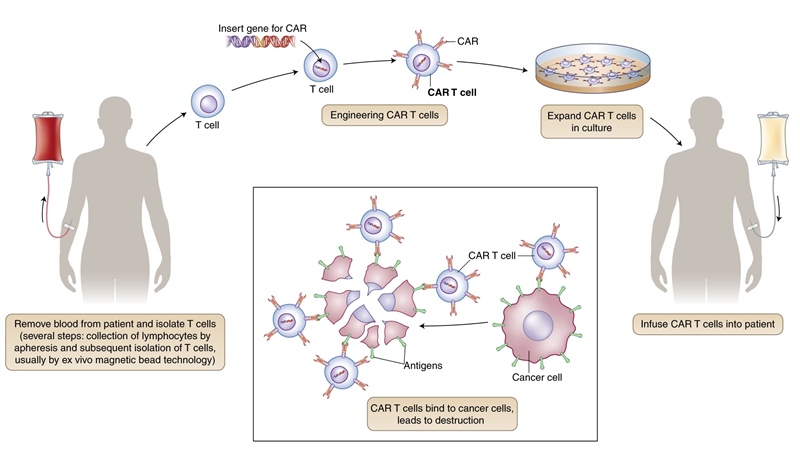
Ratele de răspuns sunt impresionante la acești pacienți, însă pot exista și efecte secundare ale acestor agenți. Unii pacienți prezintă sindrom de eliberare de citokine și reacții adverse neurologice tranzitorii. Un alt aspect este că tratamentul poate duce la aplazia celulelor B ceea ce implică necesitatea terapiei de întreținere cu imunoglobulină administrată intravenos. Date recente preconizează de asemenea, un rol important al terapiilor celulare în cazul tumorilor solide.
Terapia genică
Deși în ultimele două decenii au existat o multitudine de agenți noi care țintesc kinazele și sistemul imun, cea mai mare parte a proteomului uman nu este în prezent „druggable”, multe ținte rămânând inaccesibile. Recent a fost demonstrată eficacitatea clinică a moleculelor țintite contra KRAS-G12C, ceea ce constituie o descoperire majoră care ar putea conduce și la o aprobare terapeutică.
Noi clase de medicamente, cum ar fi terapiile de editare genică, viroterapiile oncolitice, interferpoziția siARN/ARN, PROTACs și terapiile celulare sunt cel mai probabil capabile să permită țintirea unor noi elemente ale proteomului, inaccesibile până acum. Prima terapie genică a fost aprobat în 2019 (onasemnogene abeparvovec-xioi- Zolgensma) și, deși nu se află într-o indicație oncologică, reprezintă o etapă importantă în medicină.
În prezent, există o singură viroterapie oncolitică aprobată de FDA / EMA (talimogen laherparepvec- Imlygic); interpoziția ARN se dezvoltă rapid cu o primă aprobare în 2017 (Patisiran), iar PROTACs este o nouă clasă de compuși care etichetează proteine specifice cu scopul de a le degrada.
Citește și:
- Raport IHE. Cancerul în Europa: mai multe cazuri diagnosticate, dar și mai mulți supraviețuitori. Inovația face diferența, dar există diferențe între Est și Vest în materie de acces
- Planul European pentru Cancer: consultarea publică, lansată în Parlamentul European. Care sunt principalele direcții? Ce spun președintele Comisiei Europene și comisarul european pentru sănătate?
- Pan-Cancer Project: cel mai amplu proiect de medicină genomică realizat vreodată asupra mecanismelor moleculare implicate în apariția și evoluția cancerului. Care sunt principalele rezultate?

