Accesul la terapii inovatoare în Uniunea Europeană: sinteza activității EMA în primul trimestru al 2024
EMA (European Medicines Agency) este agenția Uniunii Europene responsabilă de evaluarea științifică, supravegherea și monitorizarea siguranței medicamentelor. În cadrul său funcționează o serie de comitete, rolul principal în autorizarea medicamentelor de uz uman revenind CHMP (Committee for Medicinal Products for Human Use).
CHMP se întrunește o dată pe lună pentru a evalua aplicațiile pentru avizarea introducerii pe piață, printr-o procedură centralizată, recomandând sau nu comercializarea fiecărui medicament analizat. Află mai multe: Anul 2023 din perspectiva accesului pacienţilor la terapii inovatoare în Uniunea Europeană. Care sunt medicamentele aprobate în primul trimestru de EMA?
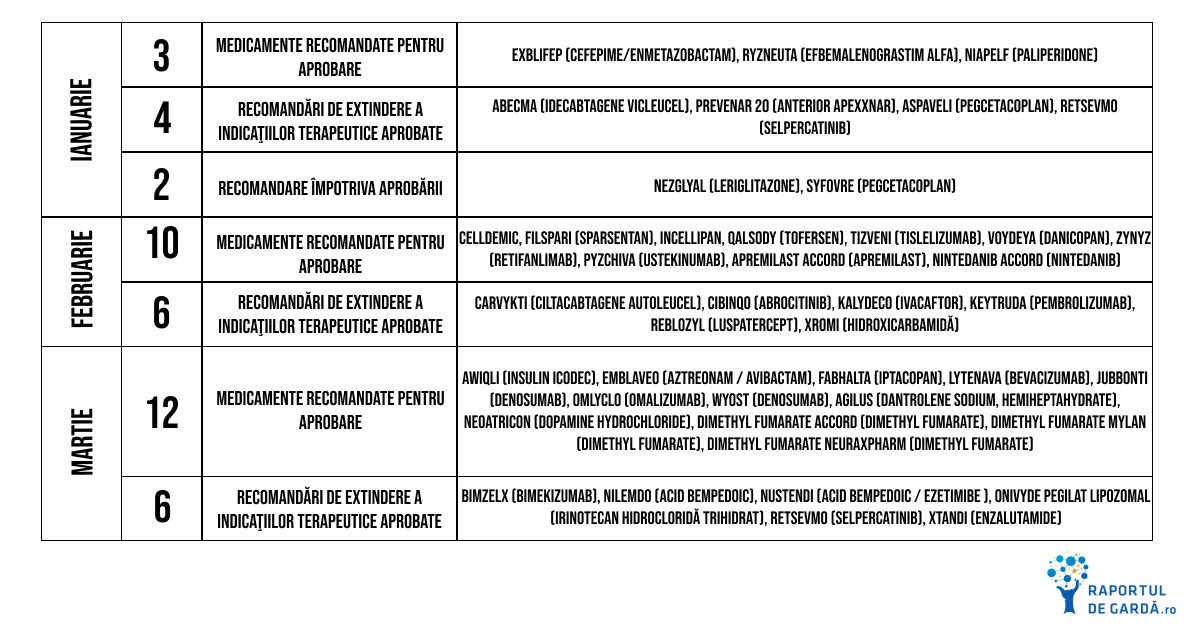
Principalele noutăți din primul trimestru al anului 2024:
- a fost autorizată prima terapie de tip CRISPR/Cas9 în Uniunea Europeană, indicată pacienților cu anemie falciformă și beta-talasemie
- CHMP a oferit aviz pozitiv unei terapii inovatoare de tip oligonucleotid antisens pentru pacienții cu scleroză laterală amiotrofică, pentru care opțiunile de tratament sunt limitate
- în martie, CHMP a recomandat aprobarea unei noi terapii pentru infecțiile severe cu bacterii rezistente la majoritatea antibioticelor, decizie urmată rapid de acordarea autorizației de către Comisia Europeană
Așa cum era așteptat, în februarie, Comisia Europeană a acordat autorizația de comercializare pentru Casgevy (exagamglogene autotemcel, exa-cel), singura terapie genetică care a fost aprobată în Uniunea Europeană pentru pacienții cu anemie falciformă și beta-talasemie. Terapia asigură producţia de hemoglobină fetală prin tehnologia CRISPR/Cas9, determinând rezoluţia simptomelor severe după o administrare unică.
Casgevy poate elimina crizele dureroase invalidante la persoanele cu anemie falciformă, precum și nevoia de transfuzii cronice de sânge pentru pacienții cu beta-talasemie. Terapia a fost concepută pentru o administrare unică pe parcursul vieții. Deoarece CRISPR editează ADN-ul la nivelul celulelor stem, efectul oferit de Casgevy ar putea, în teorie, să dureze pe toată durata vieții. Află mai multe despre Casgevy aici: ISTORIC. UK aprobă prima terapie de editare genică bazată pe CRISPR pentru anemia falciformă și β-talasemie.
Terapie pe bază de ARN pentru pacienții cu scleroză laterală amiotrofică
Scleroză laterală amiotrofică (ALS) este o boală severă și dificil de tratat. Determină deteriorarea progresivă a fibrelor nervoase care controlează mișcările voluntare, până se ajunge la paralizie, inclusiv a musculaturii respiratorii, ceea ce determină, în final, insuficiență respiratorie. Supraviețuirea medie cu ALS este de 2-5 ani. La 2% dintre pacienți, boala este cauzată de mutații ale enzimei SOD1, care au drept consecință moartea neuronală. În prezent există un singur medicament autorizat în Uniunea Europeană pentru pacienții cu ALS – riluzole.
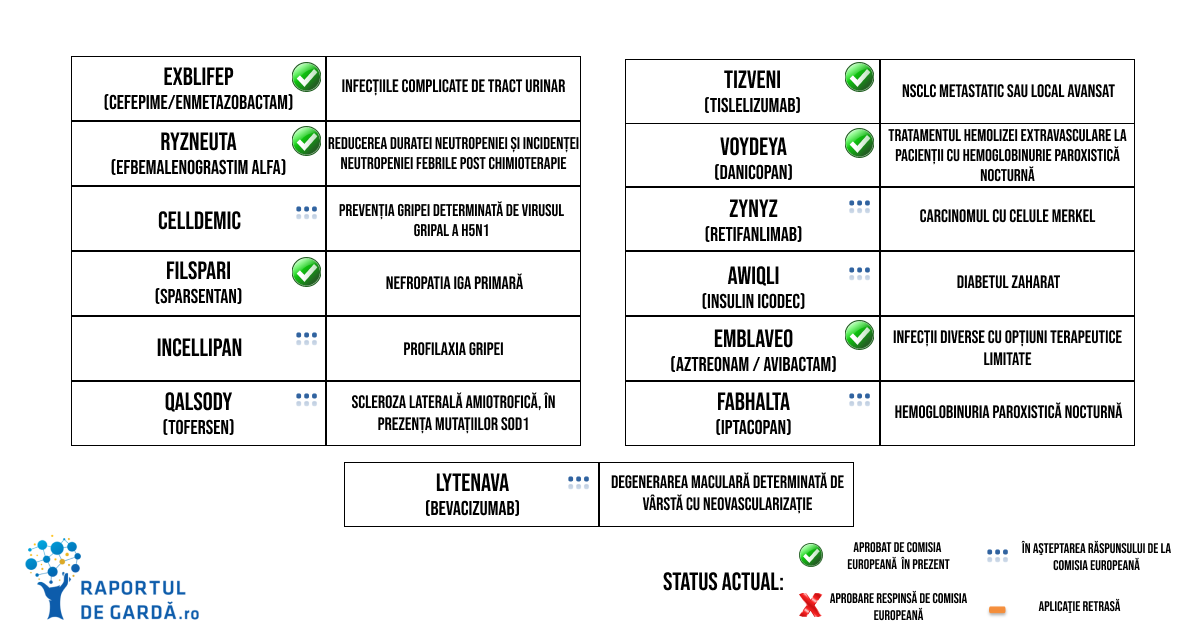
CHMP a recomandat în februarie autorizarea comercializării Qalsody, un oligonucleotid antisens care se leagă de ARN-ul mesager care conține informația transcrisă pe baza genei SOD1. În urma acestei hibridizări, este blocată sinteza de proteine SOD1 defecte, ameliorând simptomele de ALS.
Qalsody a fost evaluat în cadrul unui studiu clinic randomizat care a inclus peste 100 de pacienți cu ALS, pozitivi pentru mutațiile genei SOD-1. Pacienții au fost împărțiți în două grupuri aleatoriu (2:1) pentru a primi fie Qalsody, fie placebo timp de 24 de săptămâni. Deteriorarea axonilor a fost evaluată prin măsurarea lanțului ușor al neurofilamentelor plasmatice (NfL). La pacienții care au primit Qalsody, nivelurile NfL au scăzut cu aproximativ 60%, în comparație cu grupul de control. De asemenea, terapia investigațională a ameliorat capacitatea fizică a pacienților.
Tot în luna februarie, CHMP a oferit aviz pozitiv pentru aprobarea Voydeya, primul tratament cu administrare orală pentru anemia reziduală la pacienții cu hemoglobinurie paroxistică nocturnă. Poți afla mai multe despre recomandările elaborate de CHMP în februarie aici.
Lupta cu patogenii rezistenți la antibiotice continuă
Infecțiile determinate de bacterii Gram negative rezistente la antibiotice sunt o problemă severă de sănătate publică, fiind cauza a aproximativ 35 000 de decese pe an în Uniunea Europeană. În martie, CHMP a recomandat autorizarea Emblaveo, care conține aztreonam și avibactam, pentru a fi administrat pacienților cu infecții complicate intraabdominale și de tract urinar, pneumonie dobândită în cursul spitalizării și alte infecții determinate de bacterii aerobe Gram negative pentru care opțiunile terapeutice sunt limitate. Despre concluziile întâlnirii CHMP din luna martie poți citi aici.
Datorită beneficiilor sale clinice și urgenței problemei bacteriilor rezistente la antibiotice, Emblaveo a fost rapid aprobat de Comisia Europeană, în curs de o lună de la recomandarea CHMP. Eficacitatea sa a fost demonstrată în cadrul studiilor clinice de fază III REVISIT și ASSEMBLE. Aztreonam este un antibiotic cu structură de beta-lactamină de tip monobactam, iar avibactam este un inhibitor de beta-lactamaze. Beta-lactamazele sunt enzime produse de bacteriile rezistente la antibioticele din clasa beta-lactaminelor. Avibactam restabilește activitatea aztreonamului împotriva patogenilor care produc diverse tipuri de beta-lactamaze asociate cu infecții severe și dificil de tratat.

De asemenea, în luna ianuarie, CHMP a oferit aviz pozitiv pentru autorizarea Exblifep (cefepime-enmetazobactam), indicat pentru infecțiile de tract urinar și pneumonia dobândită în urma spitalizării. Comisia Europeană a urmat recomandarea CHMP, astfel că noua terapie a devenit disponibilă în Uniunea Europeană. Poți afla mai multe despre întâlnirea CHMP din ianuarie aici.
Citește și:
- Anul 2023 din perspectiva accesului pacienţilor la terapii inovatoare în Uniunea Europeană. Care sunt medicamentele aprobate în al doilea trimestru de EMA
- Anul 2023 din perspectiva accesului pacienţilor la terapii inovatoare în Uniunea Europeană. Care sunt medicamentele aprobate în al treilea trimestru de EMA
- Anul 2023 din perspectiva accesului pacienţilor la terapii inovatoare în Uniunea Europeană. Care sunt medicamentele aprobate în ultimul trimestru de EMA

