Terapiile bazate pe editare genică CRISPR-Cas9: cum funcționează și ce studii clinice sunt desfășurare
În 2020, Jennifer Doudna şi Emmanuelle Charpentier au primit Premiul Nobel în Chimie pentru dezvoltarea metodei de editare genică CRISPR. În prezent, la puţin peste 10 ani de la publicarea metodei în 2012, aceasta a fost remarcabil de rapid adaptată pentru aplicaţii terapeutice. Începând cu anul 2020, se află în stadii variate de investigare clinică terapii bazate pe editare genică, pentru numeroase afecţiuni. Pentru a centraliza informaţiile disponibile din studiile clinice care evaluează terapii bazate pe editare genică, Organizaţia Mondială a Sănătăţii a înfiinţat Registrul Editării Genomului Uman.
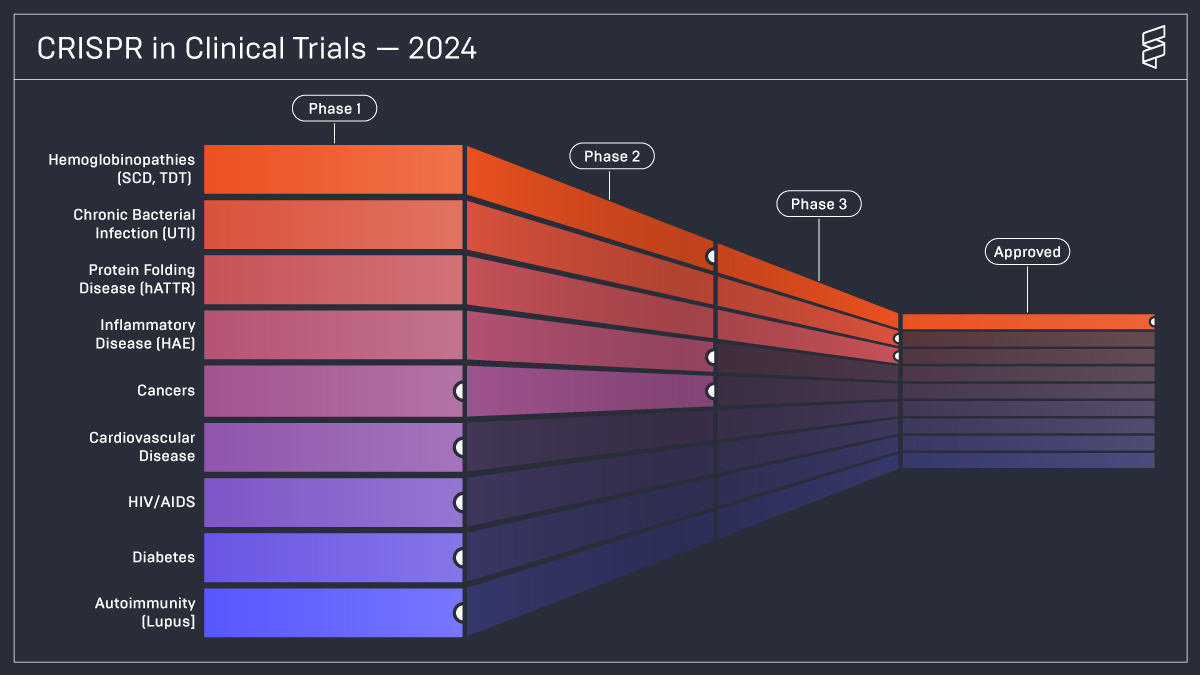
La finalul anului 2023 a avut loc un moment istoric în domeniul medicinei personalizate: prima terapie bazată pe editarea genică cu ajutorul CRISPR-Cas9 – Casvegy (exagamglogene autotemcel) – a primit autorizația din partea autorităților de reglementare din Regatul Unit, devenind disponibilă pentru a fi administrată pacienților cu anemie falciformă și beta-talasemie. Imediat după această realizare, U.S. Food and Drug Administration şi Comisia Europeană au aprobat comercializarea Casgevy în Statele Unite şi Uniunea Europeană, astfel că disponibilitatea terapiei s-a extins rapid.
Vă prezentăm în continuare modul în care funcţionează editarea genică, care sunt metodele adaptate pentru a dezvolta terapii, precum şi principalele studii clinice în care sunt investigate tratamente inovatoare bazate pe editare genică. Aceste terapii se adresează unor boli variate, incluzând hemoglobinopatiile, amiloidoza ereditară, hipercolesterolemia, infecţiile cronice, precum cele determinate de virusul imunodeficienţei umane. Totodată, editarea genică reprezintă o oportunitate de a creşte eficacitatea altor tipuri de tratamente, precum terapiile celulare CAR-T.
Care sunt metodele de editare genică?
Tehnologia CRISPR-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR associated protein 9) a fost adaptată pe baza unor fenomele naturale prezente la bacterii. Aceste microorganisme copiază segmente din materialul genetic al virusurilor care au tropism pentru acestea şi apoi, la un nou contact cu acelaşi virus, se sintetizează molecule ARN, care funcţionează precum un ghid cu scopul de a indica enzimei Cas9 ce secvenţe să atace (genomul viral).
Platforma terapeutică CRISPR-Cas9 are la bază acelaşi principiu. Este utilizat un fragment de ARN care ţinteşte o secvenţă de interes de ADN, care indică proteinei Cas9 ce structură ADN să taie, urmând adăugarea sau eliminarea unor fragmente de material genetic.
Terapiile de editare genică prezintă potențialul de a asigura controlul sau chiar vindecarea oricărei afecțiuni cu substrat genetic. Editarea genică prin CRISPR poate fi uşor adaptată ca terapie pentru diverse aplicaţii, extinzând astfel numărul de boli care pot fi ţintite. Principalele modificări necesare adesea presupun modificarea câtorva nucleotide ale moleculelor de ARN utilizate, dezvoltarea unui sistem de livrare adecvat pentru ţesuturile unde este necesară editarea genică pentru obţinerea efectului terapeutic şi alegerea uneia dintre variatele tipuri de proteine Cas.
Există variate tehnologii optimizate care au la bază platforma CRISPR. Base editing este o metodă de tip CRISPR de editare genică, care nu determină ruperea ambelor catene de ADN, astfel că ar putea fi mai sigură pentru utilizarea ca terapie. Investigarea acestei metode în studii clinice a fost iniţiată. Prime editing reprezintă o altă metodă de editare care nu determină ruperea ambelor catene de ADN, astfel că a fost dezvoltată pentru utilizare clinică. De asemenea, cantitatea de proteină produsă prin expresie genică poate fi modificată prin intermediul unor diferite tipuri de proteine CRISPR sau cu ajutorul unor editori ai epigenomului de tip CRISPR.
Majoritatea aplicaţiilor terapeutice dezvoltate pentru editarea genică sunt bazate pe tehnologia CRISPR-Cas, însă există şi alte platforme investigate. Principiul tehnologiilor de editare genică non-CRISPR:
- TALEN (transcription activator-like effector nucleases) se bazează pe proteine de legare la ADN înalt specifice de tipul efectorilor asemănători activatorilor transcrierii, care prezintă un şir de repetiţii de aminoacizi care poate fi modificat astfel încât să recunoască secvenţe specifice de ADN şi care sunt fuzionate cu domeniul de clivare a ADN-ului al nucleazei FokI. Astfel, sunt realizate modificări genomice ţintite şi înalt specifice
- Platforma de editare genică ARCUS funcţionează cu ajutorul unei enzime de editare a genomului I-CreI, care aparţine algelor Chlamydomonas reinhardtii. Aceasta desface legături şi realizează inserţii specifice la nivelul ADN-ului
- ZFN (zinc finger nucleases) sunt metode de editare genică bazate pe proteinele de tip zinc finger, care sunt factori de transcripţie şi recunosc secvenţe specifice de ADN, fuzionate cu endonucleaza Fok, care taie catena de ADN
Tratamentul hemoglobinopatiilor ereditare
Anemia falciformă şi beta talasemia sunt principalele afecţiuni pentru care s-au dezvoltat metode de terapie prin editare genică, fiind boli monogenice bine studiate şi ofertate pentru aplicaţii ale tratamentelor prin tehnologii cu substrat genetic. Aşadar, nu este deloc surprinzător că o terapie adresată acestor două boli, Casgevy, a devenit prima terapie bazată pe editare genică devenită disponibilă pentru pacienţi.
Atât anemia falciformă, cât şi beta talasemia, apar prin mutaţii ale hemoglobinei, însă în poziţii diferite, determinând consecinţe diferite. Terapiile de editare genică dezvoltate pentru aceste hemoglobinopatii au acelaşi principiu, restaurarea producţiei de hemoglobină fetală, care va compensa hemoglobina sintetizată cu defecte la adulţii care prezintă aceste mutaţii.
Spre deosebire de Casgevy, terapie dezvoltată de CRISPR Therapeutics şi Vertex Pharmaceuticals, care utilizează proteina Cas9, Editas Medicine investighează, pentru anemia falciformă severă, pentru prima dată proteina Cas12a într-un studiu clinic, datele obţinute până în prezent indicând un profil favorabil de siguranţă. Tot pentru anemia falciformă severă, Beam Therapeutics investighează într-un studiu clinic o terapie de tip base editing, fără a fi încă disponibile date cu privire la rezultatele obţinute.
Nu doar editarea genică pentru restaurarea producţiei de hemoglobină fetală prezintă interes pentru tratamentul hemoglobinopatiilor. Noi terapii bazate pe de editare genică dezvoltate de Graphite Bio şi de UC Consortium şi-au propus să repare mutaţiile prezente la nivelul genei care codifică hemoglobina.
Tratamentul amiloidozei ereditare de tip transtiretină (hATTR)
Pentru hATTR a fost dezvoltat de către Intellia Therapeutics primul sistem de livrare cu ajutorul nanoparticulelor lipidice pentru o terapie care utilizează tehnologia CRISPR-Cas9. Această terapie reduce cantitatea de transtiretină disfuncţională, astfel că previne acumularea excesivă sub formă de amiloid. Patogeneza acestei boli se aseamănă cu cea din bolile neurodegenerative, precum boala Alzheimer.
Totodată, studiul clinic în care a fost investigată terapia de editare genică pentru hATTR a marcat prima administrare sistemică la pacienţi a sistemului de editare genomică. Nanoparticulele lipidice au tendinţa de a se acumula la nivel hepatic, ceea ce este favorabil pentru terapia hATTR, deoarece transtiretina este sintetizată predominant în ficat.
Platforma terapeutică a fost adaptată de Intellia Therapeutics şi pentru angioedemul ereditar. Studiile clinice de fază precoce au avut rezultate favorabile, modul de acţiune a terapiei constând în reducerea cantităţii de markeri inflamatori din organism.
Editarea genică în contextul terapiilor celulare
Utilizarea editării genice pentru producţia terapiilor CAR-T ar putea reprezenta o metodă de a creşte eficacitatea acestora, atât prin favorizarea acţiunii asupra ţintei, cât şi prin facilitarea adoptării de celule CAR-T alogenice şi prevenirea rejetului acestora. În prezent, există rezultate publicate din evaluarea a diferite terapii CAR-T care utilizează editarea genică pentru variate leucemii şi limfoame, dar şi pentru cancere solide, precum carcinomul renal, neoplaziile gastrointestinale, cancer pancreatic şi alte tumori maligne de origine epitelială. Similar, editarea genică a fost utilizată de CRISPR Therapeutics pentru a creşte succesul terapiilor CAR-T la pacienţii cu boli autoimune, precum lupusul eritematos sistemic.
Tot pentru a preveni rejetului grefei, editarea genică poate să contribuie la acceptarea transplantului de celule pancreatice de la un donator. O astfel de terapie dezvoltată de CRISPR Therapeutics şi ViaCyte a ajuns în stadiul de evaluare în studii clinice.
Nu doar tehnologiile pe bază de CRISPR au fost adaptate pentru terapiile CAR-T, ci şi editarea genică prin TALEN a ajuns în stadiul de investigare clinică. Mai multe astfel de soluţii au fost dezvoltate de Cellectis pentru leucemii şi limfoame cu celulă B. De asemenea, Precision BioSciences evaluează în studii clincie o terapie CAR-T pentru limfoame non-Hodgkin, care presupune editare genică prin tehnologia ARCUS.

Tratamentul hipercolesterolemiei familiale
Hipercolesterolemia ereditară poate fi cauzată de mutaţii ale genei PCSK9. O terapie de editare genică de tip base editing, care a oferit rezultate promiţătoare în 2023 şi despre care se aşteaptă noi date anul acesta, este VERVE-101. Deoarece expresia acestei gene are loc predominant la nivelul ficatului, sistemul de livrare cu nanoparticule este o opţiune adecvată de a administra terapia VERVE-101. O unică administrare a acestei terapii reduce colesterolul LDL cu 50%. În plus, compania Verve Therapeutics începe în 2024 investigarea clinică a unei alte terapii de editare genică, VERVE-102, adresată, de asemenea, hipercolesterolemiei familiale heterozigote.
De asemenea, CRISPR Therapeutics a dezvoltat terapii de editare genică pentru reducerea nivelului de lipide şi prevenţia bolilor cardiovasculare, care ţintesc gena ANGPTL3 sau lipoproteina (a). Spre deosebire de terapiile VERVE Therapeutics care ţintesc variante genetice specifice, CRISPR Therapeutics a dezvoltat metode care ţintesc versiunile wild type ale celor două gene, astfel că ar putea avea aplicaţii pentru terapia unei categorii vaste de pacienţi.
Eliminarea patogenilor care determină infecţii cronice
Tratamentul infecţiei cu HIV prin ţintirea genomului viral cu ajutorul tehnologiei CRISPR-Cas9 a ajuns la nivelul studiilor clinice, în 2023 fiind raportate primele rezultate. Acestea indică un profil favorabil de siguranţă şi datele colectate până în prezent sugerează că tratamentul ar putea fi şi eficace.
Locus Biosciences a dezvoltat o metodă de a trata infecţiile urinare cu ajutorul a 3 bacteriofagi modificaţi să conţină la nivelul genomului lor sistemul CRISPR-Cas3, astfel încât să îndepărteze infecţiile cu Escherichia coli. Nu există încă date despre rezultatele evaluării clinice, însă acesta este primul studiu clinic în care s-a administrat proteina Cas3
Aceste exemple de tehnololgii utilizate de a combate infecţiile cronice şi/sau persistente ar putea fi adaptate pentru a trata şi alte afecţiuni de natură infecţioasă, principiul metodelor putând fi aplicat pentru agenţi patogeni variaţi.
Citeşte şi:
- Inovația Anului 2023 în viziunea Raportuldegardă.ro: An record pentru medicina genomică și medicina personalizată
- CRISPR/Cas9: promisiunile și provocările editării genice în medicină. Care sunt aplicațiile practice?
- Premiul Nobel pentru Chimie 2020: dezvoltarea tehnologiei de editare genomică CRISPR-Cas9

